Propionitril
Propionitril (systematischer Name Propannitril) ist eine chemische Verbindung aus der Gruppe der Nitrile. Der Trivialname leitet sich von der Propionsäure ab.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
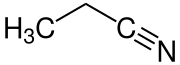 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Propionitril | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3H5N | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit etherischem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 55,08 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
97 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,3655 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten |
40–56 mg·kg−1 (LD50, Kaninchen, transdermal)[3] | |||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
15,5 kJ/mol[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Eigenschaften
Propionitril ist eine farblose, in Wasser gut lösliche Flüssigkeit mit einem charakteristischen Geruch. Es ist leicht entzündlich und die Dämpfe bilden mit der Luft explosive Gemische (3,1–14 %). Bei hohen Temperaturen zersetzt sich Propionitril unter anderem zu Blausäure und zu diversen Stickoxiden.
Verwendung
Propionitril eignet sich gut für die Weiterreaktion über Hydrolyse zu Propionsäureamid und weiter zur Propionsäure, oder über Reduktion zu Propylamin.
Herstellung
Propionitril wird üblicherweise über die Kolbe-Nitrilsynthese hergestellt, bei der in diesem Fall Ethanhalogenide (–Cl, –Br, –I) mit Alkalimetallcyaniden in polaren, aprotischen Lösungsmitteln (DMSO, Aceton) zur Reaktion gebracht werden. Da es sich bei dem eingesetzten Cyanid um ein ambidentes Nucleophil handelt, entsteht zusätzlich auch das isomere Isonitril. Das Verhältnis von Nitril zu Isonitril ist dabei von dem Reaktionstyp und den Reaktionsbedingungen abhängig.
Weitere Synthesewege zum Propionitril können mit der Hydrocyanierung als auch generell mit der katalytischen Oxidation von Kohlenwasserstoffen mit Luft in Gegenwart von Ammoniak beschritten werden. Im Falle von Propionitril führt letztere Methode vorerst nur zum Acrylnitril.
Einzelnachweise
- Eintrag zu Propionitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. November 2021. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-440.
- Datenblatt Propionitril (PDF) bei Merck, abgerufen am 19. Januar 2011.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.

