Orlistat
Orlistat ist ein Arzneistoff zur Behandlung von Adipositas (Übergewicht), der in Kombination mit einer ärztlich überwachten Reduktionsdiät eingesetzt werden soll. Es verringert – ohne den Appetit zu zügeln – die Resorption von Fett und damit die Energieaufnahme (siehe: Physiologischer Brennwert) aus dem Darm, indem fettzerlegende Enzyme gehemmt werden. Es wird so gut wie nicht resorbiert. Die bisherigen Daten zeigen, dass für einen Teil der Patienten eine Reduktion des Körpergewichts um bis zu zehn Prozent möglich ist. Somit soll Orlistat auch nicht weiter eingenommen werden, wenn der Patient nach zwölf Wochen Einnahmedauer nicht fünf Prozent seines Ausgangsgewichts verloren hat.[4]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
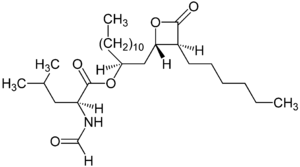 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Orlistat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C29H53NO5 | |||||||||||||||||||||
| Kurzbeschreibung |
Weißes bis fast weißes, kristallines Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
A08AB01 | |||||||||||||||||||||
| Wirkstoffklasse |
Antiadipositum | |||||||||||||||||||||
| Wirkmechanismus |
Lipasehemmer | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 495,73 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
Praktisch unlöslich in Wasser, gut löslich in Chloroform, sehr gut löslich in Methanol und Ethanol[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Orlistat wird halbsynthetisch aus dem aus Streptomyces toxytricini isolierten Lipstatin hergestellt.
Pharmakologie
Pharmakodynamik
Orlistat hemmt spezifisch und lang anhaltend fettverdauende Enzyme (Lipasen) des Magen-Darm-Traktes. Die therapeutische Wirkung beginnt innerhalb des Magens und setzt sich im Bereich des oberen Dünndarms fort. Chemisch gesehen bindet Orlistat kovalent an das aktive Zentrum der gastrischen und pankreatischen Lipase (Pankreaslipase). Dadurch werden diese Lipasen irreversibel inaktiviert und können die in Form von Triglyceriden vorliegenden Nahrungsfette nicht mehr in resorbierbare freie Fettsäuren und Monoglyceride zerlegen (hydrolysieren). In der Folge werden die Verdauung und die Resorption von bis zu 35 % der mit der Nahrung aufgenommenen Fette verhindert und so das Serumcholesterin gesenkt. Hieraus resultiert primär eine Verringerung des Körpergewichts, wodurch sich sekundär die Glucosetoleranz verbessert und erhöhte Blutdruckwerte sinken können (siehe metabolisches Syndrom). Allerdings scheint Orlistat kontraproduktiv den Appetit zu stimulieren.[5]
Pharmakokinetik
Untersuchungen bei normalgewichtigen und übergewichtigen Probanden haben gezeigt, dass der Wirkstoff nur in sehr geringem Maß vom Körper aufgenommen wird. Plasmakonzentrationen des nicht verstoffwechselten Orlistat waren acht Stunden nach der oralen Einnahme von Orlistat nicht messbar (< 5 ng/ml). Zumeist konnte bei therapeutischen Dosierungen nicht metabolisiertes Orlistat nur sporadisch und nur in äußerst niedrigen Konzentrationen (< 10 ng/ml oder 0,02 μmol) im Plasma nachgewiesen werden, wobei keine Kumulation erkennbar war. Dies lässt auf eine minimale Resorption schließen.
Anwendungsgebiete
Orlistat ist in Verbindung mit einer leicht hypokalorischen Kost zur Behandlung von adipösen Patienten mit einem Körpermasseindex (Body-Mass-Index, BMI) von ≥ 30 kg/m² oder von übergewichtigen Patienten (BMI ≥ 28 kg/m²) mit begleitenden, gewichtsabhängigen Risikofaktoren zugelassen. Die Behandlung mit Orlistat sollte nach 12 Wochen abgebrochen werden, wenn der Gewichtsverlust nicht mindestens 5 % des Körpergewichtes zu Beginn der Medikation beträgt.[4]
Für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren existieren keine klinische Studien.
Gegenanzeigen und Anwendungsbeschränkungen
Orlistat darf nicht angewendet werden bei[4]
- Chronischem Malabsorptionssyndrom
- Cholestase
- Schwangerschaft, Stillzeit
- Überempfindlichkeit gegenüber Orlistat
- Gleichzeitiger Behandlung mit Ciclosporin, mit Warfarin oder anderen oralen Antikoagulanzien.
Da die Gewichtsreduktion bei Diabetes mit einer verbesserten metabolischen Kontrolle einhergehen kann, sollten Patienten, die ein Arzneimittel gegen Diabetes nehmen, vor Beginn einer Therapie mit Orlistat einen Arzt konsultieren, weil die Dosierung des Antidiabetikums gegebenenfalls angepasst werden muss.
Während der Einnahme von Arzneimitteln zur Behandlung des Diabetes mellitus sollte eine engmaschige medizinische Überwachung erfolgen, da Orlistat einen Einfluss auf die Wirksamkeit von Blutzuckersenkern haben kann.[6]
Bei Patienten mit einer chronischen Nierenerkrankung und/oder einem Flüssigkeitsmangel ist das Risiko erhöht, dass die Behandlung mit Orlistat zu Hyperoxalurie und Oxalat-Nephropathie führen kann, die manchmal Nierenversagen zur Folge hat.
Nebenwirkung/Unerwünschte Arzneimittelwirkungen
Hauptsächlich und sehr häufig werden Magen-Darm-Nebenwirkungen beobachtet: Steatorrhoe (Fettstühle), ein unangenehmes Stuhlschmieren (anal leakage), vermehrte Darmperistaltik, Stuhldrang und vermehrter Stuhlgang und Flatulenz (Darmwinde).[7] Die Serumspiegel fettlöslicher Vitamine sinken unter Orlistat infolge einer Beeinträchtigung der Resorption durch das Medikament. Erniedrigte Werte sind für die Vitamine D, E und β-Carotin dokumentiert.[8] Normalbereiche werden zwar im Durchschnitt nicht unterschritten, jedoch können in einzelnen Fällen pathologisch erniedrigte Werte vorkommen. Unter Umständen sollte dann eine therapiebegleitende Vitamin-Ergänzung erfolgen.[4] Nachdem für die 120-mg-Dosis in der Zeit von August 2009 bis Januar 2011 21 und von Mai 2007 bis Januar 2011 für die 60-mg-Dosis 9 Verdachtsfälle für eine, in seltenen Fällen schwerwiegende, leberschädigende Wirkung aufgetreten sind, will die europäische Arzneimittelagentur prüfen, inwieweit eine Neubewertung von Orlistat erforderlich ist.[9]
Eine im Dezember 2012 publizierte Studie warnt davor, dass Orlistat andere Medikamente, z. B. Acetylsalicylsäure (Aspirin) oder Zytostatika in ihrer Wirkung negativ beeinflusst.[10][11] Die Zahl der bekannten unerwünschten Arzneimittelwirkungen hat deutlich zugenommen, seitdem der Wirkstoff auch ohne Rezept verfügbar ist.[10]
Klinische Studien
In den bisher vorgelegten placebokontrollierten vier Zweijahresstudien[12][13][14][15] und in einer Vierjahresstudie[16] wurde die Behandlung jeweils mit einer energiereduzierten (hypokalorischen) Ernährung kombiniert. Die gesammelten Ergebnisse aus diesen Untersuchungen zeigen, dass die zwölfwöchige Kombinationsbehandlung bei 37 % der behandelten Patienten und bei 19 % der Placebo-Patienten zu einem Gewichtsverlust von mindestens 5 % ihres Körpergewichtes im Vergleich zum Behandlungsbeginn führte. Wird die Behandlung weiter fortgesetzt, nehmen die Probanden noch mehr ab: 49 % der mit Orlistat behandelten Patienten und 40 % der mit Placebo behandelten Patienten verloren im ersten Jahr weitere 10 % ihres Körpergewichtes oder mehr im Vergleich zum Anwendungsbeginn. Umgekehrt kommt es ohne anfänglichen Behandlungserfolg während der ersten zwölf Wochen auch später nur selten zu einem so deutlichen Gewichtsverlust.
Insgesamt lag der Anteil von Patienten, die unter Einnahme von 120 mg Orlistat in Kombination mit einer hypokalorischen Ernährung 10 % ihres Ausgangskörpergewichtes oder mehr verloren hatten, bei 20 %, bei Placebo hingegen bei 8 %. Im Mittel betrug der Unterschied des erreichten Gewichtsverlustes zwischen Arzneimittel- und Placebo-Gruppen 3,2 kg.
Der Gewichtsverlust nach einem Jahr Behandlung mit einer gewichtsreduzierenden Diät und Orlistat bleibt unter Beibehaltung einer Orlistat-Abgabe und einer gewichtshaltenden Diät in einem zweiten Jahr signifikant besser erhalten als unter Abgabe eines Placebos. Das wieder zugenommene Gewicht im zweiten Jahr ist dabei im Mittel 3,2 (Orlistat) statt 5,6 kg (Placebo), bei einem vorhergehenden mittleren Gewichtsverlust von 8,8 kg (Orlistat) bzw. 5,8 kg (Placebo) im ersten Jahr.[17]
In klinischen Studien brechen ein Drittel der Patienten die Orlistat-Behandlung vorzeitig ab.[18]
Weitere Daten aus klinischen Studien legen die Möglichkeit nahe, dass der unter Orlistat-Anwendung erreichte Gewichtsverlust das Auftreten einer Erwachsenen-Zuckerkrankheit (Diabetes mellitus Typ II) hinauszögert.[16] Grundsätzlich können alle mit der Adipositas assoziierten Risikofaktoren günstig beeinflusst werden: Senkung des Gesamtcholesterins, Senkung des LDL- und Anstieg des HDL-Cholesterins, Senkung des Nüchtern-Blutzuckers, der Insulinkonzentrationen im Serum, Abfall der systolischen und diastolischen Blutdruckwerte. Ergebnisse aus Langzeitstudien über die Beeinflussung kardiovaskulärer Komplikationen (Herzinfarkt, Schlaganfall) und der Mortalität fehlen allerdings immer noch.
Eine weitere Studie zeigte, dass mit einer Kombinations-Behandlung aus Orlistat, hypokalorischer Ernährung, Vitaminergänzung und körperlicher Bewegung auch bei der Problemgruppe der adipösen Jugendlichen eine vergleichbare Gewichtsreduktion wie bei Erwachsenen zu erreichen ist (unter Studienbedingungen).[19] Bedenklich erscheint hier jedoch ein vermehrtes Auftreten von Knochenbrüchen unter Orlistat.[4]
Metaanalyse
In einer 2007 veröffentlichten Metaanalyse, für die 16 doppelblinde, randomisierte und Placebo-kontrollierte Studien mit einer Beobachtungsdauer von einem Jahr oder länger eingeschlossen werden konnten, zeigten mit Orlistat Behandelte gegenüber Placeboeinnehmenden eine Gewichtsabnahme von 2,9 kg (eine über Placebo hinausgehende 5%ige Gewichtsreduktion bei 21 %, eine 10%ige bei 12 % der Patienten). Die Inzidenz für Diabetes mellitus und die Plasmakonzentrationen des Gesamtcholesterins wurden gesenkt, ebenso die für LDL (um 0,27 mmol/L). Systolischer und diastolischer Blutdruck wurden im Mittel um 1–2 mmHG gesenkt, die glykämische Kontrolle gebessert. Als unerwünschte Wirkung traten gegenüber Placebo vermehrt gastrointestinale Nebenwirkungen auf und wurden die Plasmakonzentrationen des HDL geringfügig erniedrigt.[20][21]
Handelspräparate
Xenical 120 mg ist in Deutschland (zugelassen seit 1998), Österreich und der Schweiz – wie in vielen anderen Staaten – verschreibungspflichtig, d. h. nur auf Rezept erhältlich. In Griechenland, Australien und vielen Teilen Asiens wird das Medikament rezeptfrei in Apotheken verkauft.
Im Februar 2007 hat die Food and Drug Administration (FDA) und im Januar 2009 die Europäische Kommission die Zulassung für eine rezeptfreie Formulierung zu 60 mg Orlistat mit dem Handelsnamen Alli erteilt.[22][23] Von den Herstellern Hexal AG und Ratiopharm wurden im weiteren Verlauf arzneistoffgleiche Nachahmerpräparate (Generika) herausgebracht, wobei diese unter dem Arzneistoffnamen Orlistat vertrieben werden. In Österreich zeigten Testkäufe, dass das Medikament häufig auch abweichend von der Indikation und unter Missachtung der Kontraindikationen in Apotheken verkauft wird. Es gibt daher vereinzelt Überlegungen, ob der rezeptfreie Status von Orlistat ausreichend sicher ist (siehe Abschnitt Nebenwirkung/Unerwünschte Arzneimittelwirkungen).[24][25][26][27]
Weblinks
- Sina Horsthemke: Im Medizinschrank: Orlistat, Diätmittel mit Schwächen. In: Spektrum.de. Spektrum der Wissenschaft Verlagsgesellschaft, 5. Januar 2021.
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Orlistat
- Diätmittel Orlistat blockiert die Fettverdauung. In: Lebensmittel > Schlankheitsmittel und Diäten. Verbraucherzentrale Nordrhein-Westfalen e.V., 14. Dezember 2020.
Einzelnachweise
- FDA Label Xenical (PDF; 320 kB)
- Eintrag zu Orlistat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- Datenblatt Orlistat, ≥98%, solid bei Sigma-Aldrich, abgerufen am 19. Februar 2013 (PDF).
- Xenical: Zusammenfassung der Merkmale des Arzneimittels (Fachinformation) (PDF; 207 kB), Europäische Arzneimittelagentur, Stand Mai 2009.
- M. Ellrichmann, M. Kapelle u. a.: Orlistat inhibition of intestinal lipase acutely increases appetite and attenuates postprandial glucagon-like peptide-1-(7-36)-amide-1, cholecystokinin, and peptide YY concentrations. In: The Journal of clinical endocrinology and metabolism. Band 93, Nummer 10, Oktober 2008, S. 3995–3998, doi:10.1210/jc.2008-0924. PMID 18647814.
- Gegenanzeigen (Kontraindikationen) von Orlistat. In: 121doc.com. Abgerufen am 26. August 2017.
- Theodosios D Filippatos, Christos S Derdemezis, Irene F Gazi, Eleni S Nakou, Dimitri P Mikhailidis: Orlistat-Associated Adverse Effects and Drug Interactions: A Critical Review. In: Drug Safety. Band 31, Nr. 1, 2008, ISSN 0114-5916, S. 53–65, doi:10.2165/00002018-200831010-00005 (springer.com).
- Sjöström, L. et al. (1998): Randomised placebo-controlled trial of orlistat for weight loss and prevention of weight regain in obese patients. European Multicentre Orlistat Study Group. In: The Lancet. Bd. 18, S. 167–172 PMID 9683204
- European Medicines Agency starts review of orlistat-containing medicines – Evidence relating to very rare cases of liver injury to be considered in depth (PDF; 59 kB), Pressemitteilung vom 22. September 2011 (englisch).
- Dave Lavallee: Pharmacy researcher finds most popular weight-loss drug strongly alters other drug therapies. In: URI Today. University of Rhode Island, Kingston, USA, 10. Dezember 2012, abgerufen am 5. Januar 2021 (amerikanisches Englisch).
- Da Xiao, Deshi Shi, Dongfang Yang, Benjamin Barthel, Tad H. Koch, Bingfang Yan: Carboxylesterase-2 is a highly sensitive target of the antiobesity agent orlistat with profound implications in the activation of anticancer prodrugs. In: Biochemical Pharmacology. Band 85, Nr. 3. Elsevier, Februar 2013, S. 439–447, doi:10.1016/j.bcp.2012.11.026, PMID 23228697, PMC 4102434 (freier Volltext) – (elsevier.com).
- L. Sjöström, A. Rissanen u. a.: Randomised placebo-controlled trial of orlistat for weight loss and prevention of weight regain in obese patients. European Multicentre Orlistat Study Group. In: Lancet. Band 352, Nummer 9123, Juli 1998, S. 167–172, PMID 9683204.
- M. H. Davidson, J. Hauptman u. a.: Weight control and risk factor reduction in obese subjects treated for 2 years with orlistat: a randomized controlled trial. In: JAMA. Band 281, Nummer 3, Januar 1999, S. 235–242, PMID 9918478.
- S. Rössner, L. Sjöström u. a.: Weight loss, weight maintenance, and improved cardiovascular risk factors after 2 years treatment with orlistat for obesity. European Orlistat Obesity Study Group. In: Obesity research. Band 8, Nummer 1, Januar 2000, S. 49–61, doi:10.1038/oby.2000.8. PMID 10678259.
- L. Karhunen, A. Franssila-Kallunki u. a.: Effect of orlistat treatment on body composition and resting energy expenditure during a two-year weight-reduction programme in obese Finns. In: International journal of obesity and related metabolic disorders. Band 24, Nummer 12, Dezember 2000, S. 1567–1572, PMID 11126207.
- J. S. Torgerson, J. Hauptman u. a.: XENical in the prevention of diabetes in obese subjects (XENDOS) study: a randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patients. In: Diabetes care. Band 27, Nummer 1, Januar 2004, S. 155–161, PMID 14693982. Volltext
- Davidson MH, Hauptman J, DiGirolamo M, et al.: Weight control and risk factor reduction in obese subjects treated for 2 years with orlistat: a randomized controlled trial. In: JAMA. 281, Nr. 3, Januar 1999, S. 235–42. PMID 9918478.
- Padwal R, Li SK, Lau DC: Long-term pharmacotherapy for obesity and overweight. In: Cochrane Database Syst Rev. Nr. 3, 2004, S. CD004094. doi:10.1002/14651858.CD004094.pub2. PMID 15266516.
- J. P. Chanoine, S. Hampl u. a.: Effect of orlistat on weight and body composition in obese adolescents: a randomized controlled trial. In: JAMA. Band 293, Nummer 23, Juni 2005, S. 2873–2883, doi:10.1001/jama.293.23.2873. PMID 15956632. Volltext
- Diana Rucker, Raj Padwal, Stephanie K Li, Cintia Curioni, David C W Lau: Long term pharmacotherapy for obesity and overweight: updated meta-analysis. In: BMJ. 335, 2007, S. 1194–1199. doi:10.1136/bmj.39385.413113.25.
- Pharmainformation 23/1, Februar 2008
- FDA Approves Orlistat for Over-the-Counter Use 7. Februar 2007.
- Orlistat: Bald auch ohne Rezept. (Memento vom 24. Februar 2014 im Internet Archive) Pharmazeutische Zeitung online, vom 21. Januar 2009.
- Schlankheitsmittel Alli zu leicht zu kriegen. 22. Juni 2011, abgerufen am 10. Januar 2012.
- Apotheken: Einkauf von Alli – 16 Apotheken im Test. 14. Juni 2011, abgerufen am 10. Januar 2012.
- Fragwürdige Schlankheitsmittel-Abgabe in Apotheken. 22. Juni 2011, abgerufen am 10. Januar 2012.
- Baumgärtel, C.: Orlistat – rezeptfreie Abgabe, S. 16, Christoph Baumgärtel. (PDF; 8,6 MB) 1. August 2011, archiviert vom Original am 26. Dezember 2015; abgerufen am 11. Januar 2012.