Natriumazid
Natriumazid ist das Natriumsalz der Stickstoffwasserstoffsäure. Es besitzt die Formel NaN3 und gehört zur Stoffklasse der Azide.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
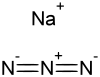 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natriumazid | ||||||||||||||||||
| Summenformel | NaN3 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 65,01 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
gut in Wasser (420 g·l−1 bei 17 °C)[1] und flüssigem Ammoniak, unlöslich in Diethylether[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
DFG/Schweiz: 0,2 mg·m−3 (gemessen als einatembarer Staub)[1][4] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung
Natriumazid entsteht beim Überleiten von Distickstoffmonoxid über Natriumamid bei 180 °C:[6][7]
Als Nebenprodukt entsteht nach folgender Gleichung Ammoniak:
Das Ende der Reaktion kann über die ausbleibende Entwicklung von Ammoniakgas bestimmt werden.
Ebenfalls erhält man Natriumazid aus Natriumamid und Natriumnitrat in der Schmelze bei 175 °C. Als Nebenprodukte entstehen Natriumhydroxid und Ammoniak.
Beschreibung/Eigenschaften
In saurer Lösung entsteht aus Natriumazid die explosive Stickstoffwasserstoffsäure HN3. Beim Erhitzen zersetzt es sich ab einer Temperatur von 275 °C. Die mittels DSC bestimmte Zersetzungswärme beträgt −54 kJ·mol−1 bzw. −835 kJ·kg−1.[8]
- (spektralanalytisch reiner Stickstoff)
In Gegenwart von Luft erfolgt zusätzlich eine Oxidation des Natriums.[9]
Das Azidion N3− gehört zu den Pseudohalogeniden. Es verhält sich in vielen Reaktionen ähnlich den Halogenidionen. Das mesomeriestabilisierte Ion ist linear und symmetrisch gebaut, mit einheitlichen Abständen zwischen den Stickstoffatomen. Deren Bindungslänge liegt zwischen der der N-N-Doppel- und Dreifachbindungen. Diese Stabilisierung fehlt bei der freien Säure und bei den Schwermetallaziden.
Anwendung
Natriumazid wird in der industriellen Synthese zur Darstellung von Bleiazid und Stickstoffwasserstoffsäure sowie von tert-Alkylaziden und anderen organischen Aziden wie Tosylazid verwendet.[2]
Die Umsetzung von Carbonylverbindungen mit Stickstoffwasserstoffsäure in stark saurem Medium liefert aus Ketonen unter Wanderung einer Alkylgruppe Amide. Werden Carbonsäuren eingesetzt, so erhält man das um ein Kohlenstoffatom ärmere Amin (Schmidt-Reaktion). Die dazu benötigte Stickstoffwasserstoffsäure wird in situ aus Natriumazid erzeugt. Eine weitere Anwendung ist die Darstellung von Alkylisocyanaten aus Carbonsäurehalogeniden (Curtius-Reaktion).
Des Weiteren wurde Natriumazid bis 1995 in Treibstoffen für Airbags verwendet, um den Luftsack zu füllen.[10]
Analyse
Analytisch macht man sich die Eigenschaft der Azide zunutze, mit Iod nur in Gegenwart von Thiolen beziehungsweise potentiellen Thiolverbindungen (wie Penicillin) zu reagieren (Iod-Azid-Reaktion). Diese Umsetzung ist sehr empfindlich; es entsteht Stickstoff und Iodwasserstoff. Zum Nachweis werden Iodlösung und wässrige Natriumazidlösung zusammengegeben. Dann wird die Probelösung (Mercaptane, Thioether, Disulfide, Thione, S-Heterocyclen) zugegeben. Nach kurzer Zeit entfärbt sich die Lösung unter Gasentwicklung. Es entsteht Stickstoff nach folgender Gleichung:[11]
Biologische Wirkung
Vielfältigen Einsatz findet Natriumazid auch in allen Bereichen als Biozid, in denen das Wachstum von Mikroorganismen verhindert werden soll. So können mit Natriumazid Gebrauchsmaterialien (Bechergläser etc.) in Laboren länger keimfrei gehalten werden. Die Chemikalie wird auch Lösungen, Dispersionen etc. zugesetzt (ca. 0,1 % bis 0,001 %), die aufgrund ihrer Zusammensetzung sehr anfällig für mikrobiellen Verderb sind (z. B. Lösungen von Biopolymeren, Proteindispersionen).
Der biochemische Wirkmechanismus besteht in der Störung der Elektronen-Transportkette der Atmungskette als Entkoppler. Das Azid-Ion blockiert – wie auch Cyanid und Kohlenstoffmonoxid – die Sauerstoffbindungsstelle im aktiven Zentrum der Cytochrom-c-Oxidase irreversibel. Dadurch kommt die ATP-Produktion zum Erliegen und die Zelle stirbt. Die Cytochrom-c-Oxidase findet sich in den meisten sauerstoffatmenden Organismen, daher ist Azid ein recht universelles Gift – auch für Säugetiere.
Sicherheitshinweise
Aus sauren Natriumazidlösungen wird Stickstoffwasserstoffsäure freigesetzt. Diese ist sehr giftig und verätzt die Schleimhäute. Wasserfreie Stickstoffwasserstoffsäure explodiert beim Erwärmen und bei geringer Erschütterung. Konzentrierte Lösungen dürfen weder erhitzt noch plätschernd umgefüllt noch mit dem Gefäß hart aufgesetzt werden. In Wasserbädern aus Metall darf Natriumazid nicht als Biozid verwendet werden, da sich an den Metalloberflächen Verkrustungen bilden können, die bei Abkratzen explodieren können.
Natriumazid hemmt spezifisch Enzyme, die Schwermetalle enthalten und wirkt daher toxisch. Das Azidion hat zudem einen stark blutdrucksenkenden Effekt. Schon die Inhalation oder die orale Aufnahme kleiner Mengen (beispielsweise 1,5 ml 10%ige Lösung) hat starke Vergiftungserscheinungen zur Folge. Stickstoffwasserstoffsäure und ihre Lösungen riechen unerträglich stechend und rufen bei Exposition Schwindel, Kopfschmerz und Hautreizung hervor.
Einzelnachweise
- Eintrag zu Natriumazid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- Eintrag zu Natriumazid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2014.
- Eintrag zu Sodium azide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 26628-22-8 bzw. Natriumazid), abgerufen am 2. November 2015.
- Datenblatt Natriumazid (PDF) bei Carl Roth, abgerufen am 14. Dezember 2010.
- Gerhard Jander, Ewald Blasius, Joachim Strähle: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. Hirzel, Stuttgart 1995, ISBN 3-7776-0672-3, S. 205.
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2. Auflage. vol. 1, Academic Press, 1963, S. 474–475.
- Grewer, T.; Klais, O.: Exotherme Zersetzung - Untersuchungen der charakteristischen Stoffeigenschaften,VDI-Verlag, Schriftenreihe Humanisierung des Arbeitslebens, Band 84, Düsseldorf 1988, ISBN 3-18-400855-X, S. 11.
- A. Eslami, S. G. Hosseini, V. Asadi: The effect of microencapsulation with nitrocellulose on thermal properties of sodium azide particles. In: Prog. Org. Coatings. 65, 2000, S. 269–274.
- IPA Abfallsteckbriefe: Altfahrzeuge: Schadstoffe und gefährliche Eigenschaften, Stand 25. Oktober 2012.
- G. Jander, E. Blasius, J. Strähle: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. Hirzel, Stuttgart 1995, ISBN 3-7776-0672-3, S. 300.


