Reduktive Aminierung
Die reduktive Aminierung (auch als reduktive Alkylierung bekannt) ist eine Variante der Aminierung, bei der eine Carbonylgruppe über ein intermediäres Imin in ein Amin überführt wird. Meist ist die Carbonylkomponente ein Keton oder Aldehyd. Die reduktive Aminierung gilt als wichtigste Methode, um Amine herzustellen. Ein Großteil der pharmazeutisch hergestellten Amine werden auf diesem Weg hergestellt.[1][2]
Reaktionsverlauf
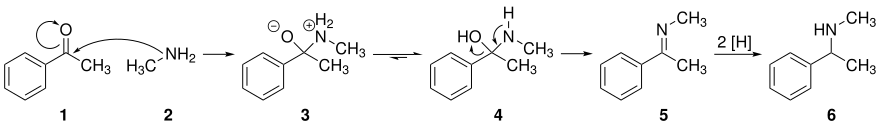
Im ersten Reaktionsschritt reagiert das Amin 2 mit der Carbonylgruppe des Ketons 1 und bildet über die zwitterionische Spezies 3 ein Hemiaminal 4. Unter Verlust von Wasser bildet sich das Imin 5. Es folgt eine Reduktion zum Amin 6. Die Gleichgewichtsreaktion zwischen Carbonyl und Amin kann auf die Seite des Imins verschoben werden, indem Wasser chemisch oder mechanisch aus dem Reaktionsgemisch entzogen wird.
Wird das Imin vor der Reduktion isoliert, wird auch von indirekter reduktiver Aminierung gesprochen. Im Gegensatz dazu wird bei der direkten reduktiven Aminierung das Imin in einer Eintopfreaktion gebildet und reduziert. Dafür werden Reduktionsmittel benötigt, die eine höhere Reaktivität gegenüber dem protonierten Imin als dem Carbonyl zeigen. Typische Reagenzien für diese Anwendung sind Natriumcyanoborhydrid (NaBH3CN) und Natriumtriacetoxyborhydrid [NaBH(OCOCH3)3].[3]
Varianten und verwandte Reaktionen
Varianten der reduktiven Aminierung sind die Leuckart-Wallach-Reaktion und die Eschweiler-Clarke-Methylierung, bei denen Ameisensäure als Reduktionsmittel dient.[4] Verwandte Reaktionen sind unter anderen die Mannich-Reaktion und die Petasis-Reaktion.
Industriell können tertiäre Amine wie Triethylamin und Diisopropylethylamin durch direkte Reaktion aus dem Keton mit einem Gasgemisch aus Ammoniak und Wasserstoff an einem Katalysator gewonnen werden.
Biochemie
Ein Schritt in der Biosynthese von vielen α-Aminosäuren ist eine reduktive Aminierung von einer α-Ketosäure durch eine Transaminase. Dieser Prozess wird durch Pyridoxalphosphat katalysiert. Im ersten Schritt bildet sich ein Imin. Die Hydrid-Äquivalente werden durch ein reduziertes Pyridin bereitgestellt. Es entsteht ein Aldimin, das zum Amin hydrolysiert.[5]
Medien
In der Serie Breaking Bad nutzt der Hauptcharakter Walter White eine reduktive Aminierung, um enantiomerenreines Methamphetamin herzustellen. Er geht dabei von Phenylaceton und Methylamin aus. Phenylaceton wird aus Phenylessigsäure und Essigsäure und einem Thoriumdioxid-Katalysator gewonnen.
Einzelnachweise
- Wyatt, Paul.: Organic synthesis : the disconnection approach. 2nd ed Auflage. John Wiley & Sons, Chichester, UK 2008, ISBN 0-470-71237-6.
- Oleg I. Afanasyev, Ekaterina Kuchuk, Dmitry L. Usanov, Denis Chusov: Reductive Amination in the Synthesis of Pharmaceuticals. In: Chemical Reviews. Band 119, Nr. 23, 11. Dezember 2019, S. 11857–11911, doi:10.1021/acs.chemrev.9b00383.
- Ellen W. Baxter, Allen B. Reitz: Reductive Aminations of Carbonyl Compounds with Borohydride and Borane Reducing Agents. In: Larry E. Overman (Hrsg.): Organic Reactions 2004, ISBN 978-0-471-17655-8, S. 1–714, doi:10.1002/0471264180.or059.01.
- George, Frederick; Saunders, Bernard: Practical Organic Chemistry, 4th Ed.. Longman, London 1960, ISBN 978-0-58244407-2, S. 223.
- Nelson, David Lee; Cox, Michael M.: Lehninger principles of biochemistry. 3rd ed. Worth Publishers, New York 2000, ISBN 1-57259-153-6.