Kaliumperchlorat
Kaliumperchlorat, das Kaliumsalz der Perchlorsäure mit der chemischen Formel KClO4, ist ein weißer kristalliner Feststoff, der stark brandfördernd wirkt und mit vielen oxidierbaren Stoffen explosionsfähige Gemische bilden kann. Bei Kaliumperchlorat liegt Chlor in der Oxidationsstufe +VII vor, der höchsten, die es einnehmen kann.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
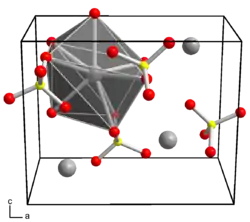 | |||||||||||||||||||
| _ K+ _ Cl7+ _ O2− | |||||||||||||||||||
| Kristallsystem |
orthorhombisch | ||||||||||||||||||
| Raumgruppe |
Pnma (Nr. 62) | ||||||||||||||||||
| Gitterparameter | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kaliumperchlorat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | KClO4 | ||||||||||||||||||
| Kurzbeschreibung |
weißes, geruchloses Pulver[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
H03BC01 | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 138,55 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
2,52 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (17 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||

Herstellung
Die Herstellung von Kaliumperchlorat erfolgt heutzutage in Perchloratzellen, in denen wässrige Lösungen von Natriumchlorat elektrolysiert werden. An der Anode bildet sich aus den Chloratanionen durch anodische Oxidation Chlortrioxid bzw. Dichlorhexoxid, welches zu Chlorat und Perchlorat hydrolysiert. Die entstandene Natriumperchloratlösung wird, nachdem das übrige Natriumchlorat mit Reduktionsmitteln wie Salzsäure oder Natriumsulfit zerstört wurde, mit Kaliumchlorid versetzt, wodurch Kaliumperchlorat ausfällt. Da Chlortrioxid sich bei hohen Temperaturen zu Chlordioxid und Sauerstoff zersetzt, müssen Perchloratzellen im Gegensatz zu Chloratzellen bei niedrigen Temperaturen betrieben werden. Als Anodenmaterial dienen in Perchloratzellen meist Platin, ähnliche Edelmetalle oder chemisch resistente elektrisch leitfähige Oxide wie beispielsweise Braunstein oder Bleidioxid.
Alternativ kann Kaliumperchlorat durch chemische Oxidation von Kaliumchlorat erhalten werden, indem man wässrige Kaliumchloratlösungen mit starken Oxidationsmitteln wie Persulfaten oder Permanganaten und geeigneten Katalysatoren versetzt.
Eine dritte Methode zur Herstellung von Kaliumperchlorat ist die thermische Disproportionierung von Kaliumchlorat, wobei aus zwei Mol Kaliumchlorat ein Mol Kaliumchlorid, ein Mol Kaliumperchlorat und ein Mol Sauerstoff entstehen.
Eigenschaften
Kaliumperchlorat bildet in reiner Form rhombische Prismen, die einige Zentimeter groß werden können. Das Kristallsystem ist orthorhombisch, Raumgruppe Pnma (Raumgruppen-Nr. 62) mit den Gitterparametern a = 8,834 Å, b = 5,65 Å und c = 7,24 Å isotyp zu Bariumsulfat.[1] Selbst leicht unreines Kaliumperchlorat bildet nur höchst feine Kristallnadeln. Es ist in kaltem Wasser wenig löslich, ist nicht hygroskopisch und bildet keine Hydrate. In polaren organischen Lösungsmitteln ist es eher schlecht löslich.[4]
Löslichkeit in verschiedenen Lösungsmitteln bei 25 °C[4][5] Lösungsmittel Wasser Methanol Ethanol n-Propanol Aceton Ethylacetat Löslichkeit in g/100 g Lösungsmittel 2,062 0,105 0,012 0,010 0,155 0,001
Außerdem wirkt es stark brandfördernd, da die Freisetzung von Sauerstoff aus Kaliumperchlorat ein schwach exothermer Vorgang ist. Die freiwerdende Energie ist allerdings sehr gering und reicht nicht aus, um weiteres Perchlorat über die Zersetzungstemperatur hinaus zu erwärmen, weshalb sich reines Kaliumperchlorat nicht explosiv zersetzen kann.
In wässriger Lösung hingegen wirkt Kaliumperchlorat viel schwächer oxidierend, als die mit ihm verwandten, niedriger oxidierten Chlor-Sauerstoff-Salze, wie zum Beispiel Kaliumhypochlorit. So oxidiert Kaliumperchlorat selbst kochende Salzsäure nur in verschwindend geringen Maßen, wohingegen Kaliumhypochlorit schon bei Zimmertemperatur unter starkem Aufschäumen und heftiger Chlorfreisetzung mit Salzsäure reagiert.
Verwendung
Kaliumperchlorat wird wegen der stark brandfördernden Wirkung und der guten Lagerbarkeit häufig in der Pyrotechnik eingesetzt, zum Beispiel als Oxidationsmittel in Blitzknallsätzen.
In Raketentriebwerken findet es nur noch selten Verwendung, da es aus diesem Anwendungsgebiet von dem mit ihm verwandten Salz Ammoniumperchlorat verdrängt wurde.
Sicherheitshinweise
Mischungen von Kaliumperchlorat mit Phosphor, Schwefel oder Metallpulvern können sich schon bei niedrigen Temperaturen entzünden. Sie können u. U. mit einem einfachen Hammerschlag heftig zur Explosion gebracht werden. Daher ist auch bei der Aufbewahrung von Chloraten und Perchloraten darauf zu achten, dass möglichst keine Verschmutzungen im Aufbewahrungsgefäß vorhanden sind.
Allerdings sind Perchlorate gegenüber Chloraten (auf Grund der Oxidationsstufe des Chlors von +VII) stabiler und haben daher die Chlorate bei der Verwendung in pyrotechnischen Mischungen abgelöst.
Einzelnachweise
- C. Gottfried, C. Schusterius: Die Struktur von Kalium- und Ammoniumperchlorat. In: Zeitschrift für Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie, 84, 1932, S. 65–73, doi:10.1524/zkri.1933.84.1.65.
- Eintrag zu Kaliumperchlorat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Eintrag zu Potassium perchlorate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Long, J.R.: Perchlorate safety: Reconciling inorganic and organic guidelines in Chem. Health Safety 9 (2002) 12–18, doi:10.1016/S1074-9098(02)00294-0.
- Willard, H.H.; Smith, G.F.: The Perchlorates of the Alkali and Alkaline Earth Metals and Ammonium. Their Solubility in Water and Other Solvents in J. Am. Chem. Soc. 45 (1923) 286–297, doi:10.1021/ja01655a004.
Weblinks
- The Chlorates and Perchlorates – Herstellung über Elektrolyse (Memento vom 6. November 2007 im Internet Archive) (englisch)

