Ammoniumperchlorat
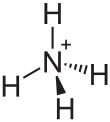
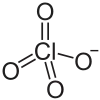
Ammoniumperchlorat (NH4ClO4) ist das Ammonium-Salz der Perchlorsäure (HClO4). Es wird oft durch Einwirken von Perchlorsäure HClO4 auf Ammoniumchlorid NH4Cl hergestellt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
  | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ammoniumperchlorat | |||||||||||||||
| Andere Namen |
Überchlorsaures Ammonium | |||||||||||||||
| Summenformel | NH4ClO4 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 117,49 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,95 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
gut in Wasser (205,9 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Eigenschaften

Ammoniumperchlorat (Summenformel NH4ClO4) bildet farb- und geruchlose, leicht wasserlösliche Kristalle, die bei Reibung, Hitze und in Gegenwart starker Säuren explodieren können. Feuergefahr besteht bei Berührung mit brennbaren Stoffen oder Reduktionsmitteln wie Schwefel, Phosphor, Metallpulver und organischen Stoffen. In stabilisiertem Zustand (z. B. mit 10 % Wasser) ist der Stoff nicht explosionsgefährlich, aber brandfördernd. Bei Kontakt treten starke Reizungen an den Schleimhäuten auf.
Der Umgang mit Ammoniumperchlorat ist im Sprengstoffgesetz geregelt und in Deutschland ohne entsprechende Erlaubnis verboten.
Ammoniumperchlorat kristallisiert orthorhombisch, Raumgruppe Pnma (Raumgruppen-Nr. 62) mit den Gitterparametern a = 9,202 Å, b = 5,816 Å und c = 7,449 Å.[3]
Ammoniumperchlorat ist in Wasser gut und polaren organischen Lösungsmitteln eher schlecht löslich.[4]
| Löslichkeit in verschiedenen Lösungsmitteln bei 25 °C[4][5] | ||||||||||||
| Lösungsmittel | Wasser | Methanol | Ethanol | n-Propanol | Aceton | Ethylacetat | ||||||
| Löslichkeit | in g/100 g Lösungsmittel | 24,922 | 6,862 | 1,907 | 0,387 | 2,260 | 0,032 | |||||
Verwendung
Ammoniumperchlorat eignet sich, mit einem Bindemittel versetzt, als Raketentreibstoff für Feststoffraketen, Feuerwerksraketen, Modellraketen oder als Sprengstoff. Der Grund dafür ist, dass sich Ammoniumperchlorat bei Initialzündung oder Erhitzung über 200 °C nach folgender Gleichung zersetzt:
Es entstehen nur gasförmige Reaktionsprodukte, die sich wegen der entstehenden Reaktionswärme explosionsartig ausdehnen. Das Ammonium-Kation wirkt als Reduktionsmittel, das Perchlorat-Anion als Oxidationsmittel. Der freigesetzte Sauerstoff und das Chlor können noch weiter oxidierend wirken. Daher wird noch bis zu 30 % (Massenanteil) Aluminium zugesetzt, das dann als eigentlicher Treibstoff dient und mit seiner hohen Reaktionstemperatur die Reaktion zwischen den Bestandteilen des Ammoniumperchlorats in Gang hält. Der spezifische Impuls ist aber trotzdem geringer als bei den meisten Flüssigtreibstoffen. Trotzdem wird und wurde Ammoniumperchlorat in Gemisch mit anderen brennbaren Substanzen (besonders Aluminiumpulver) als APCP für Raketenbooster eingesetzt, da diese einfach und billig in der Konstruktion sind, beispielsweise für Ariane 5, Space Shuttle, Titan IIIC-IVB, H-II- und Delta-Raketen. Eine weitere Verwendung findet es in Blinksternen (Strobestars), die gelegentlich auf Großfeuerwerken eingebaut und dort in Feuerwerksbomben verschossen werden.
Herstellung
Die industrielle Herstellung erfolgt elektrolytisch in der sogenannten Perchloratzelle. Dabei wird zunächst Natriumchlorid NaCl in einer wässrigen Lösung zum Natriumperchlorat NaClO4 oxidiert. Anschließend wird das Natriumperchlorat mit einem Ammoniumsalz (zum Beispiel Ammoniumchlorid NH4Cl) in einer Ionentauschreaktion umgesetzt. Dabei entsteht das Endprodukt:
Durch die verschiedenen Löslichkeiten der Salze lassen sich diese leicht trennen. Das entstandene Natriumchlorid NaCl lässt sich wiederum als Ausgangsprodukt für die Perchloratzelle verwenden.
Gefährlichkeit
Das unkontrollierte Abbrennen von Ammoniumperchlorat ist sehr gefährlich:
Der Absturz von South-African-Airways-Flug 295 am 28. November 1987 wurde laut einer Untersuchungskommission durch ein Feuer im Frachtraum verursacht; geladen war unter anderem auch das brandfördernde Ammoniumperchlorat, welches jedoch nicht in den offiziellen Ladepapieren verzeichnet war.
Am 4. Mai 1988 ereignete sich bei dem Chemieunfall bei PEPCON in Henderson, Nevada, ein verheerender Brand in einer Fabrik, die das Ammoniumperchlorat für den Raketentreibstoff der NASA herstellte und lagerte. Hierbei gab es eine Explosion, die mehr als 25 Meilen weit zu spüren war.[6]
Ammoniumperchlorat wurde 2015 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Ammoniumperchlorat waren die Besorgnisse bezüglich Exposition von Arbeitnehmern, hohes Risikoverhältnis (Risk Characterisation Ratio, RCR), anderer gefahrenbezogener Bedenken und weit verbreiteter Verwendung sowie der möglichen Gefahr durch krebsauslösende Eigenschaften sowie als potentieller endokriner Disruptor. Die Neubewertung fand ab 2015 statt und wurde von Deutschland durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[7][8] Dabei wurde Ammoniumperchlorat als endokriner Disruptor eingestuft.[9]
Einzelnachweise
- Eintrag zu Ammoniumperchlorat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- Eintrag zu Ammonium perchlorate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- C. Gottfried, C. Schusterius: Die Struktur von Kalium- und Ammoniumperchlorat. In: Zeitschrift für Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie, 84, 1932, S. 65–73, doi:10.1524/zkri.1933.84.1.65.
- Long, J.R.: Perchlorate safety: Reconciling inorganic and organic guidelines in Chem. Health Safety 9 (2002) 12–18, doi:10.1016/S1074-9098(02)00294-0.
- Willard, H.H.; Smith, G.F.: The Perchlorates of the Alkali and Alkaline Earth Metals and Ammonium. Their Solubility in Water and Other Solvents in J. Am. Chem. Soc. 45 (1923) 286–297, doi:10.1021/ja01655a004.
- Unfallbericht der Henderson-Katastrophe (PDF, englisch; 1,62 MB)
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): ammonium perchlorate, abgerufen am 26. März 2019.
- Ammonium perchlorate - Endocrine disruptor assessment - ECHA. Abgerufen am 21. Februar 2019 (britisches Englisch).


