Natriumperchlorat
Natriumperchlorat ist das Natriumsalz der Perchlorsäure.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
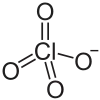 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natriumperchlorat | ||||||||||||||||||
| Andere Namen |
Irenat | ||||||||||||||||||
| Summenformel | NaClO4 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser, kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
H03BC | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 122,44 g·mol−1 (wasserfrei) 140,46 g·mol−1 (Monohydrat) | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Die industrielle Herstellung erfolgt in sogenannten Perchloratzellen. Dabei wird in Wasser gelöstes Natriumchlorat elektrolytisch zu Natriumperchlorat oxidiert. Es kann auch Natriumchlorid als Ausgangssubstanz eingesetzt werden, wobei die Zelle erst als Chloratzelle und später (bei ausreichender Konzentration von Natriumchlorat) als Perchloratzelle betrieben wird.[7]
Eigenschaften
Natriumperchlorat bildet hygroskopische farblose Kristalle. Das Kristallsystem ist orthorhombisch, Raumgruppe Cmcm (Raumgruppen-Nr. 63), mit den Gitterparametern a = 7,085, b = 6,526 und c = 7,048 Å bei 299 K.[8] Es ist auch eine Hochtemperaturform bekannt, in der die Perchlorationen fehlgeordnet sind (NaCl-Struktur, Gitterparameter a = 7,08 Å (588 K)).[9]
Natriumperchlorat ist in Wasser sehr gut und polaren organischen Lösungsmitteln gut löslich.[10]
Löslichkeit in verschiedenen Lösungsmitteln bei 25 °C[10][11] Lösungsmittel Wasser Methanol Ethanol n-Propanol Aceton Ethylacetat Löslichkeit in g/100 g Lösungsmittel 209,6 51,36 14,71 4,888 51,745 9,649
Verwendung
Der Hauptverwendungszweck von allen Perchloratsalzen ist ihre Nutzung als Sauerstofflieferant in Festtreibstoffen. Anstelle von Natriumperchlorat wird jedoch meist Ammoniumperchlorat verwendet, das industriell in einer Ionenaustauschreaktion durch Umsetzung des Natriumsalzes mit einem Ammoniumsalz hergestellt wird:
Durch die verschiedenen Löslichkeiten der Salze lassen sich diese leicht trennen. Das entstandene Natriumchlorid lässt sich wiederum als Ausgangsprodukt für die Perchloratzelle verwenden.
Anwendung in der Medizin
Perchlorat ist ein einwertiges Anion mit einem ähnlichen Ionenvolumen wie Iodid und Pertechnetat (etwa 4×10−23 cm3); es konkurriert mit Iodid am Natrium-Iodid-Symporter.[12] Natriumperchlorat (Handelsname Irenat®) hemmt daher kompetitiv die Aufnahme von Iod und auch die von Technetium in die Schilddrüse. Es wurde daher früher zur Behandlung der Hyperthyreose eingesetzt. Die einzige heutige Anwendung von Natriumperchlorat ist die Blockade der Schilddrüse bei Verabreichung iodhaltiger Kontrastmittel oder schilddrüsengängiger Radiopharmaka (123I, 131I, 99mTc), um die Strahlenbelastung der Schilddrüse gering zu halten, es sei denn, es soll die Schilddrüse selbst dargestellt werden.
Im Rahmen des Perchlorat-Depletions-Tests wird Natriumperchlorat auch zur Diagnostik von Iodverwertungsstörungen verwendet.
Sicherheitshinweise / Risikobewertung
Natriumperchlorat ist brandfördernd. Bei Verunreinung oder im Gemisch mit anderen Substanzen ist akute Brand- oder Explosionsgefahr gegeben. Bei der Zersetzung bilden sich giftige, aggressive Dämpfe.
Natriumperchlorat wurde 2015 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Natriumperchlorat waren die Besorgnisse bezüglich Exposition von Arbeitnehmern, anderer gefahrenbezogener Bedenken und weit verbreiteter Verwendung sowie der möglichen Gefahr durch krebsauslösende Eigenschaften sowie als potentieller endokriner Disruptor. Die Neubewertung fand ab 2015 statt und wurde von Deutschland durchgeführt.[13] Anschließend wurde ein Abschlussbericht veröffentlicht. Dabei wurde Natriumperchlorat als endokriner Disruptor und als potentielle SVHC-Verbindung eingestuft.[14]
Einzelnachweise
- Eintrag zu Natriumperchlorat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Datenblatt Natriumperchlorat-Monohydrat (PDF) bei Merck, abgerufen am 3. Februar 2018.
- Datenblatt Sodium perchlorate bei Acros, abgerufen am 3. Februar 2018.
- Dimethyl Sulfoxide (DMSO) Solubility Data. Gaylord Chemical Company, L.L.C.; Bulletin 102, Juni 2014, S. 14. (PDF)
- Eintrag zu Sodium perchlorate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Chase, M.W., Jr.: NIST-JANAF Themochemical Tables, Fourth Edition, J. Phys. Chem. Ref. Data, Monograph 9, 1998, 1–1951.
- Making Sodium Chlorate. Herstellung von Natriumperchlorat. Archiviert vom Original am 27. Oktober 2009; abgerufen am 29. Juli 2012 (englisch).
- R. Wartchow, H.J. Barthold: Verfeinerung der Kristallstruktur des Natriumperchlorats NaClO4. In: Zeitschrift für Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie, 147, 1978, S. 307–317, doi:10.1524/zkri.1978.147.14.307
- H.J. Berthold, B.G. Kruska, R. Wartchow: Die Kristallstruktur der orientierungsfehlgeordneten kubischen Hochtemperaturphase des Natriumperchlorats NaClO4. In: Zeitschrift für Naturforschung B. 34, 1979, S. 522–523 (online).
- Long, J.R.: Perchlorate safety: Reconciling inorganic and organic guidelines in Chem. Health Safety 9 (2002) 12–18, doi:10.1016/S1074-9098(02)00294-0.
- Willard, H.H.; Smith, G.F.: The Perchlorates of the Alkali and Alkaline Earth Metals and Ammonium. Their Solubility in Water and Other Solvents in J. Am. Chem. Soc. 45 (1923) 286–297, doi:10.1021/ja01655a004.
- T. Kuwert. Schilddrüse. In: T. Kuwert, F. Grünwald, U. Haberkorn, T. Krause: Nuklearmedizin. Stuttgart, New York 2008, ISBN 978-3-13-118504-4.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): sodium perchlorate, abgerufen am 26. März 2019.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.


