Europäischer Laubfrosch
Der Europäische Laubfrosch (Hyla arborea) ist ein Froschlurch, der zur Familie der Laubfrösche im weiteren Sinne (Hylidae) und zur Gattung der Laubfrösche (Hyla) gehört. Er ist der einzige mitteleuropäische Vertreter einer nahezu weltweit (allerdings schwerpunktmäßig neuweltlich) verbreiteten Tierfamilie, die mit gut 700 Arten zu den formenreichsten innerhalb der Amphibien zählt. Für das Jahr 2008 wurde der Europäische Laubfrosch von der Deutschen Gesellschaft für Herpetologie und Terrarienkunde (DGHT) zum Lurch des Jahres gewählt.[1]
| Europäischer Laubfrosch | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Europäischer Laubfrosch (Hyla arborea) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Hyla arborea | ||||||||||||
| (Linnaeus, 1758) |
Merkmale
Morphologie

Die Kopf-Rumpf-Länge des Europäischen Laubfrosches beträgt 3 bis 4,5 Zentimeter, bei Weibchen auch bis 5 Zentimeter. Das Körpergewicht beim Männchen kann von 3,5 bis 7 Gramm variieren, beim weiblichen Frosch je nach Jahreszeit zwischen 6 und 9 Gramm. Der Kopf ist breiter als lang; die Kopfseiten fallen steil ab, die Schnauze ist entsprechend stumpfwinklig. Die stark hervortretenden Augen besitzen waagerecht-elliptische Pupillen, die bisweilen dunkel gesprenkelte Iris leuchtet goldgelb. In der Dunkelheit weiten sich die Pupillen derart, dass sie nahezu den gesamten sichtbaren Augapfel ausfüllen. Das Trommelfell ist deutlich erkennbar und etwa halb so groß wie das Auge. Ohrdrüsenwülste (Parotiden), wie beispielsweise bei der Erdkröte, fehlen. Die vorderen Gliedmaßen sind recht kurz und weisen je vier Finger mit Haftscheiben (s. u.) an den Enden auf, die Hinterfüße haben je fünf Zehen. Die Kehle der Männchen ist gelb bis gelbbraun gefärbt und faltig, jene der Weibchen weißlich bis hellgrau und leicht gekörnelt. Männchen besitzen eine große, gelb- oder bräunliche, kehlständige Schallblase.
Haut, Färbung
Die Hautoberfläche ist glatt und kann – insbesondere beim Sonnenbaden – auffällig glänzen. Die Oberseite ist normalerweise leuchtend grün gefärbt. Der Bauch sowie die Innenflächen der Extremitäten sind vorwiegend weiß bis hellgrau und gekörnelt. Beiderseits an den Flanken zieht sich vom Nasenloch über das Trommelfell ein dunkler Streifen bis in die Leistenregion. Dort wölbt er sich nach oben und formt eine sogenannte Hüftschlinge. Speziell im Bereich dieser Hüftschlinge verläuft der Flankenstreifen bei jedem Individuum etwas anders. Die Hüftschlinge heißt auch Leistenspange, denn der schwarze Seitenstreifen endet in der Leistenregion und bildet keine Schlinge.[2] Die hellgrüne Hautfarbe entsteht durch Absorption langwelligen Lichts durch dunkle Hautpigmente, z. B. von Melanophoren (Melanocyten). Kurzwelliges Licht dagegen wird von gelben Hautpigmenten (Xanthophoren) als blaues Interferenzlicht reflektiert, das unter Mitwirkung von Lipophoren als kräftiges Grün in Erscheinung tritt. Das gelegentliche Auftreten blau gefärbter Laubfrösche beruht nachweislich auf einem Mangel an gelben Hautpigmenten und stellt damit eine Pigmentstörung in der Haut dar. Berichte über albinotische Exemplare von Hyla arborea sind äußerst selten und beziehen sich meist auf Kaulquappen oder auch auf frisch umgewandelte Juvenile. Ein solches, vollkommen gelb gefärbtes Jungtier wurde im Sommer 2007 in Holtum (Geest) im Landkreis Verden dokumentiert.[3]

Laubfrösche können in rascher Abfolge ein recht verschiedenfarbiges Aussehen annehmen. Die Variationsbreite reicht von hellgrau über gelblich bis dunkelgrün. Oft liest man in diesem Zusammenhang, dass der Frosch seine Hautfarbe der Farbe des Untergrundes anpasst, auf dem er sich gerade befindet. Dem widerspricht ein Experiment des Physiologen Biedermann, bei dem hellgrün gefärbte Hyliden nach operativer Entfernung der Augen keine dunkle Farbe angenommen haben. Vielmehr haben Tastreize, die von der Unterlage ausgehen, eine wesentliche Bedeutung auf die Hautfarbe des Tieres. Bringt man hellgrüne Laubfrösche in ein Behältnis, dessen Boden und Wände mit Filz oder mit Drahtgaze überzogen sind, werden die Tiere rasch dunkel. Auf glatten Strukturen, wie zum Beispiel Glas, bleiben sie dagegen hellgrün. Diese Reaktionen sind unabhängig von Farbe und Helligkeit. In der Natur bleibt ein Laubfrosch auf einem glatten Blatt grün, auf rauer Baumrinde wird er aber mitunter braun oder grau. Eine gewisse Rolle bei der Ausfärbung kommt der Umgebungstemperatur zu. So gilt grundsätzlich, dass mit höherer Außentemperatur die Haut umso heller erscheint.
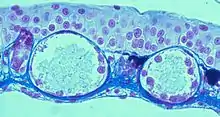
Die Haut von Hyla arborea ist außerordentlich reich an Drüsen. Generell unterscheidet man bei adulten Amphibien zwischen zwei Arten von Hautdrüsen: Schleim- und Giftdrüsen. Ihre Anzahl variiert nach Art und Körperregion. Dabei spielt auch die Lebensweise sowie der momentane Aufenthaltsort (Wasser, Land) des Tieres eine Rolle. Schleimdrüsen liegen normalerweise über die gesamte Hautoberfläche in verschiedener Dichte verteilt. Die Sekretion erfolgt durch Kontraktion der an der Drüse ansetzenden Muskulatur und unterliegt einer nervösen Regulation. Je dichter die Schleimdrüsen beieinanderliegen, umso größer ist einerseits die Hautbefeuchtung und damit der Schutz vor Austrocknung. Andererseits steigt aber durch die Sekretion die innere, physiologische Austrocknung. Bei längerem Aufenthalt im Wasser dient der Schleim als Schutzschicht gegen das Eindringen von Flüssigkeit. Bei Hyla arborea, der sich als Gebüsch- und Baumbewohner in seiner Lebensweise von anderen Lurchen sehr unterscheidet, finden sich in Aufbau und Funktion der Drüsen anatomische Besonderheiten. Sie sind als Schutz gegen Austrocknung verschließbar. Jede Schleimdrüsenzelle verfügt über einen eigenen, speziellen Schließapparat, der die Sekretionsabläufe regulieren kann.
Gehirn
Bei Laubfröschen mit 4,5 cm Körperlänge ist das Gehirn 9–10 mm lang, gemessen vom Vorderrand der Lobi olfactorii bis zum Hinterende der Nerven der Vagus-Gruppe. Die größte Breite ist im Bereich der Lobi optici und beträgt zirka 4 mm. Damit ist das Gehirn fast ebenso groß wie bei einem Teichfrosch mit 6,8 cm Körperlänge.[4]
Labyrinth
Der obere Teil besteht aus den drei Bogengängen mit je einer Ampulle, daran schließen der Utriculus und der große Sacculus an, der drei verhältnismäßig kleine, mit Sinneszellen ausgestattete Ausbuchtungen aufweist: Papilla amphibiorum, Papilla basilaris und Lagena. Die beiden Papillen perzipieren Schall. Die Papilla amphibiorum ist bei männlichen Laubfröschen im Mittel mit 70,5 Sinneszellen ausgestattet, bei weiblichen mit 77,8 Sinneszellen. Sie reagiert auf Schallwellen bis zirka 1000 Hz. Die Papilla basilaris enthält bei männlichen Laubfröschen zirka 11,2, bei weiblichen 16,3 Sinneszellen und reagiert auf Schallwellen über 1000 Hz. Der Hörbereich erstreckt sich bei 20 °C von 100 Hz bis 6500 Hz. Am niedrigsten ist die Hörschwelle bei zirka 3000 Hz, ab 4000 Hz steigt die Schwelle steil an. Fällt die Temperatur unter 20 °C, nimmt die Hörempfindlichkeit ab, steigt sie darüber bis 28 °C an, ergibt sich keine Verbesserung.[5][6]
Klettern


Laubfrösche verfügen über ein hervorragendes Haft- und Klettervermögen. Zwar sind auch andere Amphibienarten in der Lage, an glatten Flächen, selbst an Glasscheiben, ein Stück emporzuklettern – sie heften sich dabei mittels Adhäsionskräften der feuchten Bauchhaut sowie der Gliedmaßen-Unterseiten an der jeweiligen Oberfläche an. Laubfrösche besitzen als Anpassung an die kletternde Lebensweise jedoch zusätzlich an den Finger- und Zehenspitzen rundliche Haftballen, die mit bloßem Auge gut zu sehen sind. Beim Klettern an glatten Oberflächen wird das flexible Endglied der Finger auf die Unterlage gepresst und durch leichtes, rückwärts gerichtetes Ziehen fixiert. Gleichzeitig erfolgt ein Ausstoß von Gewebsflüssigkeit, die bei der weiteren Fortbewegung des Frosches als winzige, klebrige Fußspur auf der Unterlage zurückbleibt. Unter dem Rasterelektronenmikroskop (REM) erweisen sich die Oberflächen der Haftscheiben als komplexer Zusammenschluss zahlreicher kleiner Untereinheiten, die vom optischen Eindruck an ein bienenwabenartiges Muster erinnern. Bei höherer Vergrößerung ist zu erkennen, dass sich diese Feinstrukturen aus kleinen, pentagonalen, teilweise hexagonalen Säulen aufbauen. Vermutlich aus Gründen der Stabilität zeigen sie eine unregelmäßige, versetzte Anordnung. Das komplexe Zusammenspiel dieser Substrukturen ermöglicht es den Laubfröschen, selbst an spiegelglatten Flächen mühelos emporzuklettern.
Taxonomie
1960 waren u. a. Mertens und Wermuth[7] der Auffassung, dass es in Europa nur eine Laubfroschart, Hyla arborea, mit sechs Unterarten gebe: H. a. arborea, H. a. kretensis, H. a. meridionalis, H. a. molleri, H. a. sarda und H. a. schelkownikowi. Hyla intermedia galt als Synonym von H. arborea. Weitere Unterarten waren H. a. savignyi im Mittleren Osten und H. a. japonica in Japan. Die wenig differenzierte Einteilung gründete sich auf morphologische Merkmale, die bei den Laubfröschen geringe Unterschiede aufweisen.
Diese systematische Gliederung erfuhr in der Folge durchgreifende Veränderungen. Sie ergaben sich durch den Vergleich der Anzeigerufe, die spezifische Artmerkmale darstellen, und in der jüngsten Zeit durch Analysen der mitochondrialen DNS (mtDNA) und der Kern-DNS (nDNA).[8][9]
Aufgrund der Unterschiede bei den Anzeigerufen erhielten der Mittelmeer-Laubfrosch, H. meridionalis,[10] der Mittelöstliche Laubfrosch, H. savignyi,[11] und der Tyrrhenische Laubfrosch, H. sarda,[12] den Status von eigenständigen Arten. Bei den Unterarten H. a. kretensis, H. a. molleri und H. a. schelkownikowi wie auch bei H. intermedia ergaben sich dagegen keine gesicherten Unterschiede im Vergleich zum Anzeigeruf von H. arborea.[13]
Analysen der mitochondrialen DNS (mtDNA) und der Kern-DNS (nDNA) bestätigten den Artstatus von H. meridionalis und H. savignyi. Gleichzeitig enthüllten diese Untersuchungen bislang übersehene, noch unbenannte Arten wie H. felixarabica aus Süd-Arabien.[14] Die Laubfrösche in Süditalien und auf Sizilien gelten mittlerweile als eigene Art, H. intermedia. Eine nah verwandte, noch unbenannte Art wurde in der Süd-Schweiz nachgewiesen. Auch H. molleri erhielt Artstatus; ihre Verbreitung umfasst einen großen Teil der Iberischen Halbinsel. Außerdem wurde H. orientalis, die über ein großes Areal in Teilen der Ukraine, von Bulgarien, Russland, Nord-Armenien und einen kleinen Teil des Irans sowie im europäischen Teil der Türkei und in fast ganz Anatolien verbreitet ist, von H. arborea abgegrenzt.[15]
Die Anzeigerufe der Laubfrösche in der westlichen Türkei[16][17] und in Nord-Armenien, die jetzt H. orientalis zugeordnet werden, weisen nahezu identische Merkmale auf wie die von H. arborea in Südwest-Deutschland[18]. Dasselbe gilt auch für H. molleri und H. arborea, ferner für H. intermedia und H. arborea. Dass zwei Arten identische Anzeigerufe haben, ist nicht ungewöhnlich, solange sie nicht sympatrisch vorkommen und so eine Möglichkeit der Verwechslung bei der Partnerfindung nicht vorliegt[19][20].
Fortpflanzung
Rufe und Rufverhalten
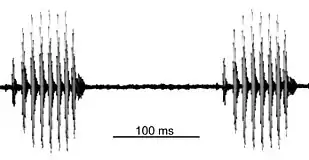
Die Anzeigerufe der Männchen werden mit „äpp ... äpp ... äpp...äpp“ umschrieben und bestehen aus gleichförmigen Impulsgruppen, die durch Intervalle deutlich voneinander abgesetzt sind (siehe Abbildung). Eine Serie solcher Impulsgruppen bildet einen Ruf. Die meisten Rufe sind aus 15 bis 30 Impulsgruppen aufgebaut, lange Rufe mit bis zu hundert oder sogar mehr Impulsgruppen geben die Laubfrösche während der Hauptlaichzeit ab. Die Impulsgruppen beginnen stets mit einem sehr leisen Impuls, zumeist bauen neun Impulse eine Gruppe auf, Abweichungen sind gering. Der Frequenzumfang reicht von 400 bis 6000 Hertz und weist zwei dominante Bereiche bei 400 bis 1200 und von 1600 bis 2400 Hertz auf.[21] In 50 Zentimetern Entfernung von einem rufenden Männchen wurden Lautstärken bis zu 87 dB gemessen.
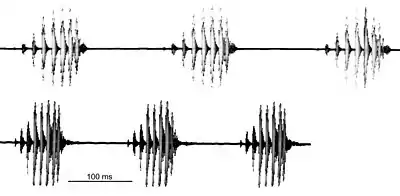
Die untere Rufschwelle liegt bei 8 °C Lufttemperatur, die obere bei 20 bis 22 °C. Die beiden Rufmerkmale Dauer der Impulsgruppen und Intervall sind mit der Lufttemperatur korreliert, sie nehmen bei steigender Temperatur ab. Bei 8 °C Lufttemperatur dauern die Impulsgruppen im Mittel 100 Millisekunden, bei 20 °C 65,7 Millisekunden. Die Intervalle messen bei 8 °C im Mittel 180 Millisekunden, bei 20 °C nur noch 82 Millisekunden. Bei dem Temperaturanstieg von 12 °C von der unteren zur oberen Rufschwelle verkürzen sich die Impulsgruppen demnach etwa um ein Drittel, die Intervalle um mehr als die Hälfte. Die Anzahl der Impulse pro Gruppe ändert sich nicht.[21] Die Veränderungen der Rufe unter dem Einfluss der Temperatur sind beim Hören mühelos feststellbar.[22]
Rufende Männchen sitzen meist am Ufer im flachen Wasser, sodass die Hinterbeine vom Wasser bedeckt sind. Andere Männchen haben Rufplätze auf Pflanzen oder Ästen gewählt oder sie liegen im Wasser und halten sich mit den Vorderbeinen an Pflanzen fest. Selten treiben sie frei auf der Wasseroberfläche. An Regentagen sitzen rufende Männchen auch ein bis zwei Meter vom Ufer entfernt auf dem nassen Untergrund. Häufig vollführen zwei Männchen über Minuten Wechselrufen. Dabei setzen die beiden Männchen ihre Impulsgruppen exakt in die Intervalle des Partners. Meist üben unmittelbar benachbarte Männchen Wechselrufen aus, bei geringer Rufaktivität können sie auch zehn Meter oder mehr voneinander entfernt sein.[21]
Ein weiterer kennzeichnender Ruftyp ist der Revierruf. Haben Laubfrosch-Männchen am Abend ihre Rufplätze gewählt, zeigen sie gegenüber anderen anwandernden Männchen territoriales Verhalten. Sobald diese zu rufen beginnen und weniger als 30 Zentimeter vom Platzhalter entfernt sind, gibt dieser Revierrufe ab, die knurrend klingen. Unter dem Einfluss der Revierrufe nehmen die Laubfrösche, meist sind es die Ankömmlinge, einen größeren Abstand ein. Nach bisherigen Ergebnissen bestimmen die Männchen anhand der Lautstärke der Rufe den Abstand voneinander.[21]
Jahres- und Tagesgang der Rufaktivität
In Südwestdeutschland im Bereich des Neckartals beginnt die Rufaktivität der männlichen Laubfrösche in den ersten Maitagen und endet etwa Mitte Juli. Der Tagesgang der Rufaktivität wird von der Lufttemperatur und der Helligkeit bestimmt.[23]
Die Männchen beginnen zu rufen, wenn am Abend die Helligkeit auf mindestens 260 Lux zurückgegangen ist. Das ist Anfang Mai gegen 19:45 Uhr der Fall. Chorrufen, bei dem erstmals zehn Männchen gleichzeitig rufen, setzt bei weniger als 60 Lux ein. Das entspricht einer fortgeschrittenen Abenddämmerung. Mit zunehmender Tageslänge verlagert sich der Beginn des Rufens kontinuierlich auf einen späteren Zeitpunkt und liegt Mitte Juni bei 21 Uhr. Nimmt danach die Tageslänge wieder ab, folgen die Laubfrösche nicht, sondern beenden etwa Mitte Juli das Rufen der aktuellen Saison. Im Verlauf der mehr als zwei Monate dauernden Rufperiode verschiebt sich der Beginn des Rufens somit um mehr als eine Stunde.[23]
Im Frühjahr liegt die Lufttemperatur am Abend noch wenig über der unteren Rufschwelle von 8 Grad und fällt verhältnismäßig schnell unter diese ab. An solchen Tagen ist die Rufphase der Männchen kurz. Ist an sehr kühlen Tagen die Lufttemperatur am Abend zur Zeit des üblichen Rufbeginns bereits unter die untere Rufschwelle abgesunken, rufen die Laubfrösche nicht. Mit fortschreitender Tageserwärmung in der folgenden Zeit und dem jetzt langsamen Absinken der Lufttemperatur bis unter die untere Rufschwelle dauern die täglichen Rufphasen bis zu zwei Stunden. Im Sommer, wenn die Lufttemperatur nicht mehr unter die untere Rufschwelle absinkt, beenden die Laubfrösche das Rufen gegen 24 Uhr und wandern wieder ab. Während der Hauptfortpflanzungszeit rufen vereinzelt Männchen die ganze Nacht.[21]
Die Laubfroschweibchen sind überwiegend stumm oder nur zu unbedeutenden Lautäußerungen fähig (leises Quietschen).
Im Spätsommer und im Herbst – bis zum Beginn der Winterruhe etwa Mitte/Ende Oktober – sind sogenannte Herbstrufe zu hören. Diese werden, anders als die Balzrufe, an sonnigen Tagen („Altweibersommer“!) aus Hecken und Gebüschen heraus geäußert und klingen eher „krächzend“ oder „knarzend“. Bei entsprechender Bestandsdichte können sich auch kurzzeitige Konzerte mehrerer Männchen ergeben. Der Sinn dieser Lautäußerungen ist unbekannt.
Die nächtlichen Rufe im Frühling sind hingegen in ihrer Funktion klar zu deuten: Es sollen Weibchen angelockt werden, die aus den Winterquartieren zum Laichgewässer wandern. Nähert sich ein Weibchen einem balzenden Männchen (wobei die stimmgewaltigsten Exemplare von den Weibchen wohl bevorzugt werden), unterbricht dieses sein Gequake und versucht sogleich, den Rücken des Weibchens zu ersteigen und dieses in der Achselgegend zu umklammern (Amplexus). Dort verbleibt es, bis es Stunden oder manchmal auch erst Tage später zum Ablaichvorgang kommt. Dabei besamt das Männchen den gerade aus der Kloake des Weibchens austretenden Laich.
Ruferzeugung
Rufende Männchen haben eine kennzeichnende Haltung. Die Vorderbeine sind gestreckt, sodass der Körper aufgerichtet ist. Der Körper und die einzelne kehlständige Schallblase sind aufgebläht, da die Männchen zum Rufen viel Luft in die Lungen und die Schallblase aufgenommen haben. Beim Rufen wird Luft im Rhythmus der Impulsgruppen zwischen Lungen und Schallblase bewegt, dabei bildet der Luftstrom aus den Lungen in die Schallblase den Schall. Während der Rufperiode ist bei den Männchen die Haut der Kehle gelb gefärbt, während sie bei den Weibchen weiß ist.[21]
Kehlkopf
Für die Stimmbildung ist der Kehlkopf mit den Stimmbändern wichtig. Er schließt direkt an die Mundhöhle an, auf ihn folgen unmittelbar die Lungen, da keine Luftröhre vorhanden ist. Der Kehlkopf besteht aus einem Knorpelring und zwei beweglichen Knorpelplatten, die den Eingang verschließen. Im rückwärtigen Teil ist ein Paar Stimmbänder in Form von straffen Ligamenten ausgebildet. Vier Paar Muskeln am Kehlkopf öffnen oder schließen seinen Eingang oder spannen und entspannen die Stimmbänder. Bei den Männchen ist der Kehlkopf größer als bei den Weibchen. Bei einem 48 mm großen Männchen hat der Kehlkopf eine Länge von 9,5 Millimeter, bei einem ebenso großen Weibchen von 3,1 Millimeter. Am Kehlkopf der Weibchen sind Stimmbänder zwar vorhanden, es sind jedoch Wülste aus weichem Gewebe.[24]
Die Feinstruktur der vier Kehlkopfmuskeln der Männchen ist identisch. Alle Merkmale weisen sie als schnelle Muskeln aus: Die Muskelfasern und Myofibrillen sind dünn, der Gehalt an Lipoiden und Glykogen ist hoch, und die Anzahl der motorischen Endplatten und der Mitochondrien ist groß. Bei den Weibchen sind die Kehlkopfmuskeln dagegen schwach ausgebildet. Sie haben auch übereinstimmende Feinstruktur, doch fehlen ihnen die Merkmale schneller Muskeln.[25][26]
Die unterschiedliche Struktur spiegelt sich in der Leistung wider, für die die Fusionsfrequenz ein Maß ist. Bei elektrischer Reizung eines Muskels ist die Fusionsfrequenz erreicht, wenn der Muskel in eine Dauerkontraktion (Tetanus) übergeht. Je höher die Fusionsfrequenz ist, desto schneller arbeitet der Muskel. Die Fusionsfrequenz nimmt bei steigender Temperatur zu. Bei den männlichen Laubfröschen haben alle vier Kehlkopfmuskeln identische Fusionsfrequenzen. Bei 10 Grad Celsius beträgt sie im Mittel 73 Hertz (= Reize pro Sekunde) und erhöht sich auf 206 Hertz bei 22 Grad. Bei den Weibchen sind die Fusionsfrequenzen der vier Kehlkopfmuskeln ebenfalls gleich, sie sind jedoch merklich niedriger als bei den Männchen. Bei 10 Grad beträgt sie im Mittel 31, bei 22 Grad 96 Hertz.[27]
Herztätigkeit
Im unteren Temperaturbereich von 5 bis 8 °Celsius liegt die Schlagfrequenz des Herzens zwischen 10 und 20 Schlägen pro Minute und nimmt bei steigender Temperatur stark zu. Bei 10 °Celsius beträgt die Schlagfrequenz im Mittel 22 Schläge pro Minute und erhöht sich auf im Mittel 69 Schläge pro Minute bei 21 °Celsius. Der Anstieg in diesem Temperaturbereich folgt einer Gleichung ersten Grades. Die weitere Erhöhung der Temperatur führt zunächst zu einer Verlangsamung, danach zu plötzlichen, starken Änderungen der Schlagfrequenz und schließlich zur Wärmelähmung des Herzens.
Am offenen Herzen wurde das Elektrokardiogramm (EKG) registriert. Unter Verwendung der beim Elektrokardiogramm des Menschen üblichen Bezeichnungen sind beim Elektrokardiogramm des Laubfrosches und anderer Froschlurche die Zacken P, R, S und T ausgebildet, während die Q-Zacke fehlt. Beim Anstieg der Temperatur verkürzen sich alle Anteile des Elektrokardiogramms, die Zacken erheblich weniger als die zeitlichen Anteile zwischen ihnen.[28]
Laich


Die Eiablage findet überwiegend im April und Mai statt, früheste Beobachtungen von Laich stammen von Ende März, späteste von Juni.[29] Die oft etwas unförmigen Laichballen, die im Wasser etwa bis zu Walnussgröße aufquellen können, werden an seichten Stellen an die Gewässervegetation wie etwa untergetauchte Halme geheftet. Die Eizahl je Ballen beträgt zwischen 30 und 80, selten auch bis zu 100. Dafür kann ein Weibchen aber mehrere Dutzend davon in einer Nacht absetzen, so dass innerhalb eines Frühjahrs insgesamt zwischen 150 und 1100 je Weibchen abgelegt werden können. Die Eier sind oberseits gelblich bis hellbraun, unterseits cremeweiß gefärbt. Der Eidurchmesser beträgt 1,5 bis 2 Millimeter, die umgebenden Gallerthüllen messen drei bis vier Millimeter.
Nach der Eiablage richten sich die Eier im Laichballen so aus, dass der gelblich-bräunlich pigmentierte animale Pol nach oben und der weißliche, unpigmentierte vegetative Pol nach unten zeigt. Die Entwicklungsdauer der Gelege variiert nach den vorherrschenden Umgebungs- und Wassertemperaturen. In Laichballen, die zum Boden des Gewässers absinken, entwickeln sich die Embryonen deutlich langsamer als in Gelegen, die unter der Wasseroberfläche direkt dem Sonnenlicht ausgesetzt sind.
Larven



Geschlüpfte Larven sind zunächst etwa drei bis fünf Millimeter lang und von hellgelber Färbung, die mit zunehmendem Alter in ein goldüberlaufenes Olivgrün wechselt. Für die Larvalentwicklung bis zur Metamorphose benötigen sie je nach Wassertemperatur und Ernährungszustand zwischen 50 und 80 Tagen. Kurz vor der Umwandlung sind die Kaulquappen zwischen 35 und 50 Millimetern groß. Sie besitzen einen lang auslaufenden, kräftigen Ruderschwanz mit auffällig breiten Flossensäumen. Der obere Saum reicht bis zwischen die Augen – ein wichtiges Bestimmungsmerkmal für Feldherpetologen. Die Augen liegen in der Draufsicht in weitem Abstand zueinander an den Kopfseiten. Laubfroschkaulquappen sind hervorragende Schwimmer, die sich blitzschnell feindlichen Zugriffen entziehen können. Ihre Hautoberfläche schimmert im Sonnenlicht gold-grünlich. Die Atemöffnung ihrer inneren Kiemen (Spiraculum) befindet sich an der linken Körperflanke. Die Oberlippe trägt zwei Zahnreihen, die Unterlippe drei.
Die Haftscheiben werden schon im letzten Stadium der Larvalphase voll funktionsfähig ausgebildet. Der Übergang zum Landleben erfolgt in Mitteleuropa überwiegend in den Monaten Juli und August. Bei günstigen Witterungsverhältnissen können bereits Mitte Juni die ersten frisch metamorphosierten Jungtiere an Land angetroffen werden. Sind die Sommermonate überwiegend kühl und verregnet, kann es auch vorkommen, dass die Laubfroschlarven ihre Entwicklung im Oktober noch nicht vollzogen haben. Solche Exemplare haben dann kaum eine Überlebenschance, da die Überwinterung der Larven bei dieser Amphibienart in der Regel nicht erfolgreich ist, auch, weil die Tiere gegenüber niedrigen Temperaturen besonders empfindlich reagieren.
Ernährung
Während der Keimentwicklung im Ei, aber auch noch im Anheftstadium nach dem Schlupf ernähren sich die Larven durch den im Körper deponierten Dottervorrat. Sobald die Kaulquappen frei schwimmen, beginnen sie mit der aktiven Nahrungssuche. Im Allgemeinen fressen sie unselektiv organisches Material, das ihnen vor die Raspelzähnchen und Hornkiefer kommt. Überwiegend sind dies mikroskopisch kleine Algen (Grünalgen, Diatomeen) sowie Einzeller und Detritus aus ihrer direkten Umgebung. Dabei werden Pflanzen, Steine und andere Oberflächen nach solchen Nahrungspartikeln abgeweidet. Ältere Larven knabbern auch an Tierkadavern, wie zum Beispiel toten Fischen und Lurchen sowie ertrunkenen Mollusken und Landinsekten. Beim Auffinden solcher Nahrungsquellen werden die Kaulquappen offensichtlich durch Geruchs- bzw. Geschmacksstoffe geleitet. Wie viele Amphibienarten stellt auch der Laubfrosch nach der Metamorphose seine Ernährung völlig um.
Heranwachsende wie adulte Laubfrösche begeben sich normalerweise mit Einbruch der Dämmerung auf Nahrungssuche. Beutetiere finden sich überwiegend am Boden oder in dessen Nähe – es werden aber auch Flug- und Laufinsekten auf den erhöhten Tagessitzwarten nicht verschmäht. Der entscheidende optische Fangreiz entsteht durch die Bewegung des Opfers; regungslose Kleinorganismen werden nicht wahrgenommen. Bei der Überwältigung der Nahrungstiere spielt die klebrige Zunge eine wichtige Rolle. Diese ist am vorderen Mundboden verwachsen und komprimiert. Ist das Opfer in Reichweite, schnellt die Zunge hervor und befördert es ins Maul. Oft bewegt der Frosch dabei gleichzeitig seinen Körper in Richtung Beute oder springt diese regelrecht an. Überhaupt nutzt der Lurch sein reichhaltiges Repertoire an Bewegungsfähigkeit. Rasches, teilweise weites Hüpfen kommt ebenso wie behändes Rennen sowohl in der Horizontalen als auch in der Vertikalen zum Einsatz. Klettern und Hangeln – auch kopfüber – sind für Hyla arborea normale Bewegungsabläufe. Mangels Zähnen wird das Nahrungstier im Ganzen hinuntergeschluckt; bei größeren Brocken unterstützt das Einziehen der Augäpfel die Arbeit der Schlundmuskulatur.

Die nächtliche Aktivitätsdauer wird stark von den jeweiligen Umgebungsfaktoren wie Temperatur und Feuchte bestimmt. Gefressen werden Insekten nahezu aller vorhandenen Arten, daneben Spinnen und, in Ausnahmefällen, auch kleine Nacktschnecken. Genaue Nahrungsuntersuchungen liegen von U. Tester (1990) und H.-J. Clausnitzer (1986) vor. Demnach besteht der Hauptanteil der Nahrung aus Käfern (Coleoptera, 34,2 %) und Zweiflüglern (Diptera) wie beispielsweise Fliegen und Mücken (47,2 %); Spinnen (Araneae, 4,3 %), Ameisen (Formicidae, 1,6 %), Schmetterlinge (Lepidoptera, 1,1 %) und Zikaden (Cicadina, 1,1 %) machten bei diesen Untersuchungen nur geringe Anteile aus.
Verbreitung
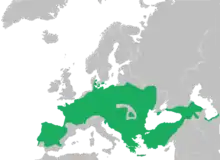
Durch die Abgrenzung des Östlichen Laubfrosches als eigenständige Art, Hyla orientalis, erfuhr das Areal von H. arborea eine beträchtliche Reduktion. Es umfasst West- und Mitteleuropa, Südschweden, erstreckt sich im Osten bis in das zentrale Polen, schließt den westlichen Teil der Ukraine ein, ferner den westlichen Balkan, Griechenland und Kreta. Auf den Britischen Inseln und in den baltischen Republiken fehlt die Art.
Deutschland
Die Nominatform des Europäischen Laubfrosches kommt (bzw. kam) in allen Bundesländern vor und besiedelt bevorzugt flache bis wellig geformte Bereiche der Tiefebene und des Hügellandes (planar-colline Höhenstufe). Für die wärmeliebende Amphibienart stellt diese Höhenstufe offensichtlich eine klimatisch bedingte Limitierung dar. Auch in den eher sommerkühlen Landschaften nahe der Nordsee (Ostfriesland, Emsland, Unterelbe) bestehen wohl natürliche Vorkommenslücken. In den meisten westlichen Bundesländern ist die Verbreitung aber vor allem aufgrund starker Bestandsrückgänge diskontinuierlich und verinselt, in den östlichen Bundesländern dagegen teilweise noch deutlich stetiger. Nennenswerte aktuelle Verbreitungsschwerpunkte des Laubfrosches befinden sich unter anderem in Teilen Mecklenburg-Vorpommerns, in der Mittelelbe-Niederung Sachsen-Anhalts und Niedersachsens sowie im Bereich des Leipziger Tieflandbeckens. Nach gezielten Artenschutzmaßnahmen durch Gewässerneuanlagen und Biotoppflege konnten sich in einigen Regionen, beispielsweise im westfälischen Münsterland, vormals stark reduzierte Bestände in letzter Zeit wieder etwas erholen. In Hessen werden vierzig Standorte verzeichnet, mit den Schwerpunkten Kreis Darmstadt-Dieburg, wo Experten 1200 Männchen gezählt haben, Bingenheimer Ried in der Wetterau[30] und im Werra-Meißner-Kreis.[31]
Schweiz und Österreich
In der Schweiz war die Art einst weit verbreitet, vor allem in tieferen Lagen. Der Rückgang dieser Art verlief hier noch rascher als in Deutschland. Die Laubfrösche in Tessin gehören zur erst 2018 abgetrennten Art Hyla perrini und wurden früher als Italienischer Laubfrosch eingestuft.[32]
In Österreich sind die aktuellen Bestände schwer einschätzbar; ein wichtiges Verbreitungszentrum ist die Gegend um den Neusiedler See.
Lebensräume

Je nach saisonaler Aktivität beanspruchen Laubfrösche sehr unterschiedliche aquatische und terrestrische Teillebensräume. Für einen erfolgreichen und nachhaltig gesicherten Lebenszyklus sind die folgenden Biotoptypen und Strukturen relevant:
Aquatische Teillebensräume – Reproduktionshabitate
- Fischfreie, besonnte Kleingewässer (Tümpel, Weiher, Druck-/Qualmwasserbereiche, Bracks, Flutmulden und Altwässer in Fluss- und Bachauen, zeitweilig überschwemmte Grünlandsenken, auch Gewässer in Abbaugruben)
- Vegetationsreiche, amphibische Flach- und Wechselwasserzonen (als Metamorphose- und Reifehabitat für juvenile Exemplare)
- Wasser- und Sumpfpflanzengesellschaften aus Laichkräutern (Potamogeton spec.), Flutrasen (v. a. Glyceria fluitans), Sauergrasrieden (Seggen, Binsen) sowie Röhrichten.
Terrestrische Teillebensräume – Tagesverstecke, Nahrungshabitate

- Extensiv bewirtschaftete Feucht- und Nasswiesen als Nahrungslebensraum für heranwachsende und erwachsene Exemplare
- Gehölzstreifen, Röhrichte und gewässerbegleitende Hochstaudenfluren als Sitz- und Rufwarten außerhalb der Paarungszeit sowie als Biotopverbundstrukturen (s. u.)
- Auwälder, Feldgehölze, durchsonnte, feuchte Niederwälder, Landschilfbestände auf grundwassernahen Standorten.
Als Sitzwarten werden von erwachsenen und heranwachsenden Tieren neben Sträuchern und sogar Baumkronen vor allem verschiedene krautige Pflanzenarten gewählt. In der Literatur werden oft Brombeergebüsche erwähnt; nach eigenen Beobachtungen werden außerdem die großen Blätter von Kletten (Arctium spec.) besonders gern zum Sonnenbaden genutzt. Offen ist bei dem Beispiel allerdings, ob diese Strukturen von den Fröschen gezielt bevorzugt werden oder man sie auf den großen Blattoberflächen nur einfacher entdeckt.
Vergesellschaftung
Begleitarten von Laubfröschen im Laichhabitat sind je nach Naturraum und Region (hier bezogen auf Deutschland) mehr oder weniger regelmäßig: Grasfrosch, Moorfrosch, Knoblauchkröte, Erdkröte, Wechselkröte, Kreuzkröte, Teichfrosch, Kammmolch, Teichmolch sowie die – allerdings seltenen – Rotbauch- und Gelbbauchunken. In etwas höheren Lagen teilen sich Laubfrösche manchmal mit dem Bergmolch das Laichgewässer. Das syntope Vorkommen in einem Habitat ist dabei nicht etwa Ausdruck einer symbiotischen Wechselbeziehung, sondern resultiert aus gemeinsamen Ansprüchen an Lebensraumqualitäten (beispielsweise: stark besonnte, krautige Flachgewässer ohne Fische; s. u.). Die verschiedenen Amphibienarten koexistieren im Laichgewässer mehr oder weniger friedlich, können aber auch als Konkurrenten um Ressourcen und als gegenseitige Fressfeinde in Erscheinung treten. So erbeuten größere Froschlurche bei Gelegenheit kleinere Exemplare der eigenen oder anderer Arten und Molche gelten als Laich- und Larven-Räuber. Auch Kaulquappen der Knoblauchkröte wird gelegentlich nachgesagt, dass sie die kleineren Laubfroschlarven dezimierten.
Überwinterung
Als wechselwarmes (poikilothermes) Tier benötigt der Laubfrosch grundsätzlich frostfreie, terrestrische Überwinterungsplätze wie Erdhöhlen, große Laubhaufen, Bodenlückensysteme im Wurzelbereich von Laubbäumen sowie Stein- und Bodenspalten. (Böden unter Nadelbäumen sind aufgrund ihres hohen Gehalts an sauren Huminstoffen für die Überwinterung eher ungeeignet.) Gelegentlich werden auch Wühlmausbauten und Maulwurfsgänge als Quartier genutzt. Das Aufsuchen der Winterquartiere ist von den jeweils herrschenden Witterungsverhältnissen abhängig. In Mitteleuropa begibt sich der Laubfrosch in der Regel im Laufe des Monats Oktober zur Winterruhe – in der Oberrheinebene geschieht dies etwa zeitgleich mit der Gelbbauchunke.
Fressfeinde
.jpg.webp)

Laubfroschlarven erreichen nur in Gewässern mit relativ geringem Feinddruck und einem ausreichenden Wasserpflanzenangebot in nennenswerter Zahl die Metamorphose. Insbesondere Fische, auch sogenannte „Friedfische“ wie beispielsweise Karpfen, reduzieren Laich und Larven der Lurchbestände erheblich, sodass solche Gewässer in der Regel keine Reproduktionsgewässer in einer Metapopulation des Laubfroschs sind.
Auch räuberische Wasser- und Schwimmkäfer sowie deren Larven (z. B. Dytiscidae, darunter der „Gelbrandkäfer“), größere Wasserwanzen (z. B. Skorpionswanzen (Nepidae), Rückenschwimmer, Ruderwanzen) und die Larven von Großlibellen (Anisoptera) sind Fressfeinde (Prädatoren) von Laubfroschlarven. Die Larven der Blaugrünen Mosaikjungfer (Aeshna cyanea) schwimmen die Kaulquappen von unten her an, ergreifen sie mit ihrer Fangmaske an der Schwanzwurzel und fressen sie bis auf den spiraligen Darmtrakt auf.
Auch zahlreiche Vogelarten wie Graureiher, Weißstorch, Purpurreiher, Nachtreiher, Rallenreiher sowie verschiedene Rabenvögel sind als Prädatoren bekannt. Hin und wieder wurden Überreste von Laubfröschen in Gewöllen von Eulen nachgewiesen.
(Zu Amphibien als Fressfeinde siehe Absatz Vergesellschaftung.)
Parasiten
Laubfrösche beherbergen als Larven wie auch als erwachsene Tiere eine Vielzahl von Parasiten. So finden sich in Darm und Leber der Kaulquappen die Amöben Entamoeba ranarum und Entamoeba histolytica sowie das Wimpertierchen Opalina ranarum. Die pathogenen Wirkungsweisen von E. histolytica (Erreger der Amöbenruhr) sind im Gegensatz zum Menschen im Amphibienorganismus nahezu unschädlich. Die Infektion der Kaulquappen erfolgt über die Nahrungsaufnahme.
Äußere Organe wie Haut und Kiemen von Amphibienlarven werden unter anderem durch die Wimpertierchen Charchesium polypinum sowie Trichodina pediculus besiedelt. Eine hohe Befalldichte von Ch. polypinum kann zum Tode führen. Trichodina lebt auf der Haut von Kaulquappen und wandert gelegentlich auch in die Harnblase ihres Wirts ein. Beim gemeinsamen Auftreten von Fischen und Amphibienlarven ist hin und wieder die Karpfenlaus (Argulus foliaceus) als Hautparasit an Laubfroschlarven zu beobachten.
Nahezu alle Amphibien sind von parasitierenden Trematoden (Saugwürmer) befallen, deren adulte Stadien vielfach in Atmungs- und Exkretionsorganen sowie im Verdauungskanal leben (Endoparasiten). Saugwürmer besitzen hakenkranzförmige Bauchsaugnäpfe zur Anheftung, verursachen aber in ihrem natürlichen Wirt nur geringe Schäden. Zur ernsten Bedrohung werden sie entweder bei Massenbefall oder, wenn sie bei Tierarten auftreten, die normalerweise nicht als Wirt fungieren. Einer der häufigsten Amphibienparasiten unter den Trematoden ist Polystomum integerrimum, der auch in der Harnblase von Laubfröschen zu finden ist. Dieser Saugwurm hat seinen Lebenszyklus exakt mit dem Biorhythmus seines Wirts synchronisiert. So setzen die Parasiten ihre Fortpflanzungsstadien ebenfalls in dem Zeitraum ab, in dem auch die Wirtstiere die Eiablage vollziehen. Damit gelangen Parasitenlarven (Mirazidien) und Kaulquappen gemeinsam in dasselbe Gewässer. Die Mirazidien heften sich an die Kiemen der Kaulquappen und ernähren sich dort von Schleimpartikeln. Im Verlauf der Metamorphose, wenn die Kaulquappe zum Frosch wird und ihre Kiemen verliert, wandern die Trematodenlarven über den Nahrungskanal in das Urogenitalsystem ein und erreichen die Harnblase. Nach drei Jahren werden die Parasiten dort geschlechtsreif und der Zyklus kann erneut beginnen.
Im Bereich des Darms ist Acantocephalus ranae ein typischer Vertreter, der auch bei Laubfröschen häufiger auftreten kann. Für die Verbreitung und Vermehrung dieses Parasiten sind Zwischenwirte wie Wasserasseln, Flohkrebse und Ostrakoden ("Muschelkrebse") erforderlich. Kommt es zu einem Massenbefall, durchbrechen die Parasiten die Darmwand des Wirts und dringen vielfach in die Leibeshöhle ein. Acantocephalus ranae tritt bevorzugt bei gesundheitlich geschwächten Laubfröschen auf.
Gefährdung und Schutz
Ursachen der Gefährdung
Mit der Trockenlegung von Niedermooren und Gewässern sowie der Begradigung der meisten Bäche und Flüsse begann bereits Anfang bis Mitte des 20. Jahrhunderts der flächenhafte Verlust an geeigneten Lebensräumen. Habitatfragmentierung durch immer mehr bauliche Maßnahmen (Straßen-, Siedlungsbau) sowie die intensivierte Landwirtschaft mit Begleiterscheinungen wie Flächenentwässerung, Tümpelverfüllung, Heckenrodung, riesigen Ackerschlägen, Pestizideinsatz etc. verstärkten den Bestandsrückgang des Laubfrosches in Mitteleuropa nach dem Zweiten Weltkrieg noch deutlich – bis heute dauert dieser Abwärtstrend in vielen Regionen an. Das Aussetzen von Fischen in Kleingewässern kann ebenfalls negative Folgen für den Amphibienbestand haben. Neben dem eigentlichen Lebensraumverlust sind Laubfrösche zusätzlich dadurch gefährdet, dass sie häufig zwischen den saisonalen Teillebensräumen wechseln. So fallen die Frösche bei ihren Wanderungen auch noch dem Straßenverkehr zum Opfer. Insbesondere Jungtierwanderungen erleiden dabei erhebliche Verluste.
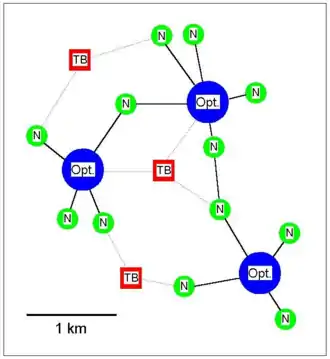
Die Verinselung ehemals vernetzter Lebensräume ist für den relativ kurzlebigen Laubfrosch besonders fatal. Zum Verständnis dieses Zusammenhangs wird in der Tierökologie das sogenannte „Metapopulations-Modell“ angewandt. Die nebenstehende Grafik soll dies veranschaulichen: Die großen blauen Kreise stellen Optimalbiotope dar, die als Refugien und Ausbreitungszentren von individuenreichen „Überschusspopulationen“ fungieren. Durch Abwanderungen von dort werden suboptimale Nebenkolonien („N“) in deren Umfeld stabilisiert, so dass sich dort trotz individuell hoher Sterblichkeit kleinere Bestände halten können. Zusätzlich dienen „Trittsteinbiotope“ („TB“), die als Dauerlebensraum weniger geeignet sind, als biotopvernetzende temporäre Aufenthaltsorte für Individuen, die in der ansonsten intensiv bewirtschafteten Gegend umherwandern. Über Nebenkolonien und Trittsteinbiotope bestehen so zumindest mittelbar auch populationsökologische Wechselbeziehungen zwischen den Optimalbiotopen. Voraussetzung für das Funktionieren dieses Modells ist u. a. die „biologische Durchdringbarkeit“ der Landschaft: Amphibien„freundliche“ Linienstrukturen (Hecken etc.) spielen dabei eine wesentliche Rolle. Die Grafik verdeutlicht auch, dass der Wegfall bereits einzelner Neben- oder Trittsteinbiotope das Verbundnetz empfindlich beeinträchtigen oder unterbrechen kann. Wird sogar ein Optimalbiotop destabilisiert oder zerstört, ist davon das gesamte direkt verknüpfte Umfeld betroffen. Das Aussterberisiko erhöht sich auch hier wegen ausbleibender Zuwanderungen erheblich, obwohl es dort selbst keine qualitativen Veränderungen gegeben hat.
Schutzmaßnahmen und Wiederansiedlung
Als Sympathieträger in der Bevölkerung und im Naturschutz gleichermaßen erfüllt der Laubfrosch wichtige Kriterien einer „Leitart“, die stellvertretend für ganze Lebensgemeinschaften mit ähnlichen Ansprüchen gefördert wird. Vordringlich für den Schutz ist der Erhalt der bestehenden Fortpflanzungsgewässer. Laubfrösche können aber auch durch Neuanlage von Kleingewässern in der Feldflur sowie in Kies- und Tongruben unterstützt werden. Optimale Gewässer weisen süd- bis südwestexponierte Lagen auf, sollten also mindestens ab dem Spätnachmittag einer mehrstündigen Sonneneinstrahlung ausgesetzt sein. Dies begünstigt sowohl die Entwicklung der Larven als auch die wärmebedürftigen erwachsenen Tiere. Im nördlichen Randbereich des Laichplatzes empfiehlt sich eine Anpflanzung von Gebüschen wie Schlehe, Hasel oder Brombeeren. Sie dienen als Verstecke und zugleich als Schutz gegen kühle Nordwinde. Eine Bepflanzung mit Nadelgehölzen ist nicht ratsam, da diese in der Regel nicht naturraumtypisch ist und von den Fröschen gemieden wird.
Verallgemeinernd lässt sich sagen, dass mehrere nah beieinanderliegende kleinere Laichgewässer der Bestandsförderung dienlicher sind als ein einzelnes großes, womöglich ziemlich tiefes Gewässer. Um gute Laichbedingungen für kopfstarke Subpopulationen zu ermöglichen, sollten diese Gewässer aber doch jeweils eine Mindestgröße von 100 m² aufweisen und über ausgedehnte Flach- und Wechselwasserzonen verfügen. Hierbei bewährt sich die Anlage von Gewässern unterschiedlicher Wassertiefe (Differenzen zwischen 20 und 50 cm Wassertiefe), da hiermit sowohl eine Gewährleistung der Laichplatzeignung in Trockenperioden (schwankender Grundwasserstand) als auch die regelmäßige Fischfreiheit (Austrocknen/Durchfrieren) gesichert werden kann. Da sich die Tiere immer nur zeitweise in den Teillebensräumen aufhalten, ist für einen effektiven Laubfroschschutz ein lokal abgestimmtes Biotopmanagement erforderlich. Damit sind folgende landschaftspflegerische Maßnahmen verbunden:
- Sicherung von Kleingewässern
- Rückschnitt von Gehölzen am Ufer der Laichgewässer (zur Vermeidung der Beschattung)
- Wahrung/Förderung eines Biotopverbundsystems (linienartige Saumstrukturen wie Strauchhecken und Baumreihen)
- Pflegekonzept zum Erhalt von Feucht- und Nasswiesen (gezielte Flächenmahd hinsichtlich Zeitpunkt und Ausführung)

Beispielsweise neigen ungenutzte Nasswiesen häufig zur Verschilfung, vor allem bei nährstoffreichen Bodenverhältnissen. Um einen zumindest teilweise offenen Grünlandcharakter zu erhalten oder wiederherzustellen, wird zunächst ein zweimaliger Schnitt des hohen Aufwuchses pro Jahr durchgeführt. Zum Schutz juveniler, frisch metamorphosierter Laubfrösche sollte der erste Mahdtermin allerdings nicht vor Juli vorgenommen werden. Der zweite Schnitt erfolgt im Oktober. Nach deutlicher Reduzierung der Dynamik des Schilf- und Hochstaudenwachstums kann in Folge auf die jährliche Mahd verzichtet werden. Ein Zyklus mit Intervallen von zwei bis drei Jahren ist dann meist ausreichend. Wo Landschilfbestände erhalten bleiben sollen, sind keine weiteren Pflegemaßnahmen erforderlich. Dies ist beispielsweise dort der Fall, wo Schilfgürtel als Pufferzone zwischen landwirtschaftlichen Nutzflächen und gefährdeten bzw. geschützten Gewässern fungieren.
Die als Beispiele genannten Pflegemaßnahmen sind aufwändig und je nach Flächengröße des zu schützenden Lebensraum auch maschinen- und kostenintensiv. Für gefährdete Vorkommen kann eine fortlaufende Betreuung und Dokumentation (Monitoring) des „Ist-Zustandes“ ein hilfreiches Mittel sein, das Erlöschen einer Population abzuwenden. Hier sind der behördliche und der ehrenamtliche Naturschutz (Verbände, Gruppen) gleichermaßen gefordert.
Leben Laubfrösche im Bereich von gesetzlich streng geschützten Flächen (Naturschutzgebiet, Naturdenkmal, Nationalpark-Kernzone, Biosphärenreservats-Kernzone, FFH-Gebiet), sind darüber hinaus detaillierte „Pflege- und Entwicklungspläne“ zu erarbeiten. Auf ausreichenden Schutz von Pufferzonen ist in diesen Bereichen besonders zu achten.
Ferner ist es von Bedeutung, dass im unmittelbaren Bereich von Laubfroschhabitaten keine chemischen Mittel (Dünger, Pestizide) zum Einsatz kommen. Befinden sich solche Flächen in Privateigentum, so ist die Bereitschaft der jeweiligen Nutzer am ehesten dadurch zu erreichen, dass finanzielle Entschädigungen für die Duldung von Pflegemaßnahmen angeboten werden (staatliche Extensivierungsprogramme, Landschaftspflegerichtlinie), Vertragsnaturschutz vereinbart wird oder ein Flächenankauf durch die öffentliche Hand bzw. Naturschutzverbände erfolgt.
Regional gibt es über die Schutzbemühungen vorhandener Vorkommen hinaus auch Versuche zur Wiederansiedlung von Laubfröschen in ehemaligen Verbreitungsgebieten. Voraussetzung für das Gelingen derartiger, nicht unproblematischer Maßnahmen ist aber immer das Bereitstellen geeigneter Habitatstrukturen (aquatisch wie terrestrisch) in entsprechender Dimension und guter räumlicher Vernetzung.
Schutzstatus und Rote-Liste-Einstufungen

Gesetzlicher Schutzstatus (Auswahl)[33]
- Fauna-Flora-Habitat-Richtlinie (FFH-RL): Anhang IV (streng zu schützende Art)
- Bundesnaturschutzgesetz (BNatSchG): streng geschützt
Rote Liste-Einstufungen (Auswahl)[34][35]
- Rote Liste der Bundesrepublik Deutschland: 3 – gefährdet
- Rote Liste Österreichs: VU (entspricht: gefährdet)
- Rote Liste der Schweiz: EN (entspricht: stark gefährdet)
- Rote Liste IUCN (Weltbestand): LC (entspricht: nicht gefährdet)[36]
Synonyme

Bisherige wissenschaftliche Synonyme sind:
- Rana arborea Schwenkfeld, 1605
- Ranunculus viridis Gesner, 1617
- Rana viridis Linnaeus, 1746 (F. S. ED. I)
- Calamita arboreus Schneider, 1799
- Hyla viridis Daudin, 1803
- Calamitas arborea A. Risso, 1826
- Hyas arborea Wagler, 1830
- Raganella arborea Bonaparte, 1830
- Dendrohyas arborea Tschudi, 1839
- Dendrohyas viridis Fitzinger, 1843
Im deutschsprachigen Raum wird der Laubfrosch unter anderem auch als „Heckenfrosch“, „Grünrock“ oder (inzwischen selten) als „Wetterfrosch“ bezeichnet.
Verwandte Arten
Mit dem Europäischen Laubfrosch eng verwandt sind die folgenden Arten der Paläarktis:
- Hyla heinzsteinitzi Grach, Plesser & Werner, 2007
- Italienischer Laubfrosch, Hyla intermedia Boulenger, 1882
- Japanischer Laubfrosch, Hyla japonica Günther, 1858
- Mittelmeer-Laubfrosch, Hyla meridionalis Boettger, 1874
- Portugiesischer Laubfrosch, Hyla molleri Bedriaga, 1890
- Hyla perrini Dufresnes et al., 2018
- Tyrrhenischer Laubfrosch, Hyla sarda (De Betta, 1857)
- Mittelöstlicher Laubfrosch, Hyla savignyi Audouin, 1827
Der in Italien (einschließlich Sizilien) und in der Schweiz (Tessin) vorkommende Italienische Laubfrosch (Hyla intermedia) wird erst seit kurzem als eigene Art geführt und ähnelt dem Europäischen Laubfrosch sehr. Auch der Portugiesische Laubfrosch (Hyla molleri) galt bisher als Unterrat bzw. Varietät von Hyla arborea, wird seit 2008 aufgrund von molekulargenetischen Untersuchungen von einigen Autoren aber als eigene Art postuliert.[8] Bei dem in Südfrankreich, Nordwestitalien, Spanien, Portugal und Nordwestafrika lebenden Mittelmeer-Laubfrosch (Hyla meridionalis) endet der dunkle Flankenstreifen direkt hinter dem Oberarmansatz. Der auf Korsika, Sardinien, Elba, Capraia und einigen weiteren Mittelmeerinseln vorkommende Tyrrhenische Laubfrosch (Hyla sarda) hat einen Seitenstreifen, der bis zur Rumpfmitte verläuft und sich danach in einzelne Streifen und Flecken auflöst. Zudem befinden sich auf Rücken und Gliedmaßen dunkelgrüne Flecken und die Haut ist weniger glatt. Seine Schnauze ist leicht verkürzt, wodurch der Kopf breiter wirkt.
Quellen
Literatur
- Josef Blab, Petra Brüggemann, Harald Sauer: Tiere in der Zivilisationslandschaft. Teil 2. Raumeinbindung und Biotopnutzung bei Reptilien und Amphibien im Drachenfelser Ländchen. Bundesforschungsanstalt für Naturschutz und Landschaftsökologie, Bonn-Bad Godesberg 1991, ISBN 3-88949-175-8.
- Christa Clausnitzer, Hans-Joachim Clausnitzer: Erste Ergebnisse einer Wiederansiedlung des Laubfrosches Hyla arborea (Linnaeus, 1758) im Landkreis Celle (Niedersachsen). (Salientia: Hylidae). In: Salamandra, DGHT, Rheinbach 1984, 20 (1), S. 50–55, ISSN 0036-3375.
- Hans-Joachim Clausnitzer: Zur Ökologie und Ernährung des Laubfrosches Hyla a. arborea (Linnaeus, 1758) im Sommerlebensraum (Salientia: Hylidae). In: Salamandra, DGHT, Rheinbach 1986, 22, S. 162–172, ISSN 0036-3375.
- Hans-Joachim Clausnitzer, Friedo Berninghausen: Langjährige Ergebnisse von zwei Wiedereinbürgerungen des Laubfrosches mit Vorschlägen zum Artenschutz. Natur und Landschaft, Kohlhammer, Stuttgart 1991, 66 (6), S. 335–339, ISSN 0028-0615.
- Eduard M. Egiasarjan & Hans Schneider: The mating calls of tree frogs in Armenia (Anura, Hylidae). In: Zoologischer Anzeiger. Band 225, 1990, S. 113–122.
- Irenäus Eibl-Eibesfeld: Vergleichende Verhaltensstudien an Anuren. 1. Zur Paarungsbiologie des Laubfrosches. In: Zeitschrift für Tierpsychologie. Band 9, Parey, Berlin/Hamburg 1952, S. 382–395, ISSN 0044-3573.
- Arno Geiger (Hrsg.): Der Laubfrosch (Hyla arborea L.). Ökologie und Artenschutz. Mertensiella, Bd. 6, Rheinbach/Bonn 1995, ISBN 3-9801929-5-4.
- Dieter Glandt: Der Laubfrosch. Ein König sucht sein Reich. Zeitschrift für Feldherpetologie, Laurenti, Bochum 2004, Beiheft 8, ISSN 0946-7998.
- Wolf-Rüdiger Grosse: Der Laubfrosch. (= Die Neue Brehm-Bücherei. Band 615). Westarp, Magdeburg 1994, ISBN 3-89432-407-4.
- Wolf-Rüdiger Grosse, Rainer Günther: Laubfrosch – Hyla arborea (Linnaeus, 1758). In: Rainer Günther (Hrsg.): Die Amphibien und Reptilien Deutschlands. G. Fischer, Jena 1996, ISBN 3-437-35016-1, S. 343–364.
- Wolf-Rüdiger Große, Marcel Seyring: Europäischer Laubfrosch − Hyla arborea (Linnaeus, 1758). In: Die Lurche und Kriechtiere (Amphibia et Reptilia) des Landes Sachsen-Anhalt. Berichte des Landesamtes für Umweltschutz Sachsen-Anhalt 4, 2015, S. 291–312.
- Václav Gvoždik: Second species of tree frog Hyla orientalis (formerly H. arborea), from Iran confirmed by acoustic data. In: Herpetology Notes. Band 3, 2010, S. 41–44.
- Uğur Kaya, A. M. Simmons: Advertisement calls of tree frogs Hyla arborea and Hyla savignyi (Anura, Hylidae) in Turkey. In: Bioacoustics. Band 10, 1999, S. 175–190.
- Uğur Kaya: Morphological investigation of Turkish tree frogs Hyla arborea and Hyla savignyi (Anura, Hylidae) in Turkey. In: Israel Journal of Zoology. Band 47, 2001, S. 123–134.
- Rafael Márquez: Hyla arborea (Linnaeus, 1758). Ranita de San Antón. In: J. M. Plegezuelos, R. Márquez, M. Lizana (Hrsg.): Atlas y libro rojo de los anfibios y reptiles de España. Madrid, 2. Auflage, 2002, ISBN 84-8014-450-5, S. 114–115.
- Robert Mertens, Heinz Wermuth: Die Amphibien und Reptilien Europas. Verlag Waldemar Kramer, Frankfurt am Main 1960, 264 S.
- Andreas Nöllert, Christel Nöllert: Die Amphibien Europas. Kosmos Naturführer. Franckh-Kosmos, Stuttgart 1992, ISBN 3-440-06340-2.
- Hans Schneider: Die Paarungsrufe einheimischer Froschlurche (Discoglossidae, Pelobatidae, Bufonidae, Hylidae). In: Zeitschrift für Morphologie und Ökologie der Tiere. Band 57, 1966, S. 119–136.
- Hans Schneider: Rufe und Rufverhalten des Laubfrosches Hyla arborea arborea (L.). In: Zeitschrift für vergleichende Physiologie. Band 57, 1967, S. 174–189, ISSN 0044-3638.
- Hans Schneider: Morphologie des Larynx von Hyla a. arborea (L.) und Hyla meridionalis Boettger (Amphibia, Anura). In: Zeitschrift für Morphologie der Tiere. Band 66, 1970, S. 299–309.
- Hans Schneider: Die Steuerung des täglichen Rufbeginns beim Laubfrosch, Hyla arborea arborea (L.). In: Oecologia (Berl.). Band 8, 1971, S. 310–320.
- Hans Schneider: Structure of the mating calls and relationships of the European tree frogs (Hylidae, Anura). In: Oecologia (Berl.), Band 14, 1974, S. 99–110.
- Hans Schneider: Bioacoustic demonstration of Hyla a. arborea in western Turkey (Anura: Hylidae). In: Zoology in the Middle East. Band 21, 2000, S. 77–85.
- Hans Schneider: The range of Hyla arborea and H. savignyi (Anura: Hylidae) on the south coast of Turkey. In: Zoology in the Middle East. Band 23, 2001, S. 61–69.
- Hans Schneider: Der Laubfrosch, Hyla arborea: Rufe, Verhalten, Systematik. In: Dieter Glandt und Andreas Kronshage (Hrsg.): Der Europäische Laubfrosch (Hyla arborea). In: Zeitschrift für Feldherpetologie. Supplement, Band 5, 2004, S. 9–26.
- Hans Schneider: Bioakustik der Froschlurche – Einheimische und verwandte Arten. Mit Audio-CD. Supplement der Zeitschrift für Feldherpetologie 6. Laurenti Verlag, Bielefeld 2005, ISBN 3-933066-23-9 (Hörbeispiele 8.1-8.4.).
- Hans Schneider, Ulrich Sinsch: Contributions of bioacoustics to the taxonomy of the Anura. In: Harold Heatwole, Michael J. Tyler (Hrsg.): Amphibian Biology. Band 7, Systematics, 2007, S. 2893–2932. Chipping Norton NSW, Australia, (Surrey Beatty & Sons).
- Hans Schneider, Wolf-Rüdiger Große: Hyla arborea (Linnaeus, 1758) − Europäischer Laubfrosch In: Kurt Grossenbacher (Hrsg.): Handbuch der Reptilien und Amphibien Europas. Band 5/II Froschlurche (Anura) II (Hylidae, Bufonidae). 2009, ISBN 978-3-89104-655-5, S. 5–83.
- Matthias Stöck, Sylvain Dubey, Cornelya Klütsch, Spartak N. Litvinchuk, Ulrich Scheidt, Nicolas Perrin: Mitochondrial and nuclear phylogeny of circum-Mediterranean tree frogs from the Hyla arborea group. In: Molecular Phylogenetics and Evolution. Band 49, Nr. 3. Elsevier, Dezember 2008, S. 1019–1024, doi:10.1016/j.ympev.2008.08.029 (PDF, 1,2 MB).
- Matthias Stöck, Christophe Dufresnes, Spartak N. Litvinchuk, Petros Lymberakis, Sébastien Biollay, Matthieu Berroneau, Amaël Borzée, Karim Ghali, Maria Ogielska, Nicolas Perrin: Cryptic diversity among western palearctic tree frogs: postglacial range expansion, range limits, and secondary contacts of three European tree frog lineages (Hyla arborea group). In: Molecular Phylogenetics and Evolution, Band 65, 2012, S. 1–9.
- Urs Tester: Artenschützerisch relevante Aspekte zur Ökologie des Laubfrosches (Hyla arborea). Inauguraldissertation Naturwiss. Univ. Basel, 1990.
Einzelnachweise
- European Tree Frog - Frog of the Year 2008 (Memento vom 16. Mai 2009 im Internet Archive), Artikel abgerufen am 30. Mai 2008
- Hans Schneider, Wolf-Rüdiger Große: Hyla arborea (Linnaeus, 1758) – Europäischer Laubfrosch In: Kurt Grossenbacher (Hrsg.): Handbuch der Reptilien und Amphibien Europas. Band 5/II Froschlurche (Anura) II (Hylidae, Bufonidae). 2009, ISBN 978-3-89104-655-5, S. 5–83.
- Webseite mit Fotos eines gelben Albino-Laubfrosches (Jungtier) (Memento vom 19. April 2014 im Internet Archive)
- Andreas Knorr, Hans Schneider: Beitrag zur Morphologie des Gehirns von Hyla arborea arborea (L.) (Hylidae, Anura). In: Bonner zoologische Beiträge, Band 26, 1975, S. 370–382.
- Bernd Alfs, Hans Schneider: Vergleichend-anatomische Untersuchungen am Labyrinth zentraleuropäischer Froschlurch-Arten (Anura). In: Zeitschrift für Morphologie und Ökologie der Tiere, Band 76, 1973, S. 129–143.
- Ludger Hubl, Hans Schneider: Temperature and auditory thresholds: Bioacoustic studies of the frogs Rana r. ridibunda, Hyla a. arborea, and Hyla a. savignyi (Anura, Amphibia). In: Journal of Comparative Physiology, Band 130, 1979, S. 17–27.
- Robert Mertens, Heinz Wermuth: Die Amphibien und Reptilien Europas. Verlag Waldemar Kramer, Frankfurt am Main, 1960. 264 S.
- Matthias Stöck, Sylvain Dubey, Cornelya Klütsch, Spartak N. Litvinchuk, Ulrich Scheidt und Nicolas Perrin: Mitochondrial and nuclear phylogeny of circum-Mediterranean tree frogs from the Hyla arborea group. In: Molecular Phylogenetics and Evolution. Band 49, Nr. 3. Elsevier, Dezember 2008, ISSN 1055-7903, S. 1019–1024, doi:10.1016/j.ympev.2008.08.029 (PDF, 1,2 MB).
- Matthias Stöck, Christophe Dufresnes, Spartak N. Litvinchuk, Petros Lymberakis, Sébastien Biollay, Matthieu Berroneau, Amaël Borzée, Karim Ghali, Maria Ogielska, Nicolas Perrin: Cryptic diversity among western palearctic tree frogs: postglacial range expansion, range limits, and secondary contacts of three European tree frog lineages (Hyla arborea group). In: Molecular Phylogenetics and Evolution, Band 65, 2012, S. 1–9
- Hans Schneider: Bio-akustische Untersuchungen am Mittelmeer-Laubfrosch. In: Zeitschrift für vergleichende Physiologie, Band 61, !968, S. 369–385.
- Hans Schneider, Eviatar Nevo: Bio-acoustic study of the yellow-lemon treefrog. Hyla arborea savignyi Audouin. In: Zoologische Jahrbücher, Abteilung Physiologie, Band 76, 1972, S. 497–506
- Hans Schneider: Structure of the mating calls and relationships of the European tree frogs (Hylidae, Anura). In: Oecologia (Berlin), Band 14, 1974, S. 99–110.
- Hans Schneider, Ulrich Sinsch: Contributions of bioacoustics to the taxonomy of the Anura. In: Harold Heatwole and Michael J. Tyler (Hrsg.): Amphibian Biology, Volume 7, Systematics. 2007, S. 2893˗2932. Chipping Norton NSW, Australia, (Surrey Beatty & Sons).
- Václav Gvoždik, Jiřŕ Moravec, Cornelya Klütsch, Petr Kotlik: Phylogeography of Middle Eastern tree frogs (Hyla, Hylidae, Amphibia) as inferred from nuclear and mitochondrial DNA variation, with a description of a new species. In: Molecular Phylogenetics and Evolution, Band 55, 2010, S. 1146–1166.
- Václav Gvoždik: Second species of tree frog Hyla orientalis (formerly H. arborea), from Iran confirmed by acoustic data. In: Herpetology Notes, Band 3, 2010, S. 41–44.
- Uğur Kaya, A. M. Simmons: Advertisement calls of tree frogs Hyla arborea and Hyla savignyi (Anura, Hylidae) in Turkey. In: Bioacoustics, Band 10, (1999), Band 10, S. 175–190.
- Hans Schneider: Bioacoustic demonstration of the tree frog, Hyla arborea, (Amphibia, Anura) in western Turkey. In: Zoology in the Middle East, Band 21; 2000, S. 77–85.
- Hans Schneider: Rufe und Rufverhalten des Laubfrosches Hyla arborea arborea (L.). In: Zeitschrift für vergleichende Physiologie, Band 57, 1967, S. 174–189, ISSN 0044-3638
- Hans Schneider und Institut für den Wissenschaftlichen Film: Akustische Orientierung beim Weibchen des Mittelmeer-Laubfrosches. Film C 1500 des IWF, Göttingen 1983. Publikation von H. Schneider, Publ. Wiss. Film, Sekt. Biol., Ser. 17, Nr. 21/C 1500, 1985. 13 S.
- Hans Schneider, E. Nevo, G. Heth, S. Samson, J. Brzoska: Auditory discrimination tests of female near eastern tree frogs and reevaluation of the systematic position (Amphibia, Hylidae). In: Zoologischer Anzeiger, Band 213, 1984, S. 306–312.
- Hans Schneider: Rufe und Rufverhalten des Laubfrosches Hyla arborea arborea (L.). In: Zeitschrift für vergleichende Physiologie, Band 57, 1967, S. 174–189, ISSN 0044-3638
- Hans Schneider: Bioakustik der Froschlurche – Einheimische und verwandte Arten. Mit Audio-CD. Supplement der Zeitschrift für Feldherpetologie 6. Laurenti Verlag, Bielefeld 2005. ISBN 3-933066-23-9
- Hans Schneider: Die Steuerung des täglichen Rufbeginns beim Laubfrosch, Hyla arborea arborea (L.). In: Oecologia (Berlin), Band 8, 1971, S. 310–320.
- Hans Schneider: Morphologie des Larynx von Hyla a. arborea (L.) und Hyla meridionalis Boettger (Amphibia, Anura). Zeitschrift für Morphologie und Ökologie der Tiere, Band 66, 1970, S. 299–309.
- Helga Eichelberg, Hans Schneider: Die Feinstruktur der Kehlkopfmuskeln des Laubfrosches, Hyla arborea arborea (L.), im Vergleich zu einem Skelettmuskel. In: Zeitschrift für Zellforschung, Band 141, 1973, S. 223–233.
- Helga Eichelberg, Hans Schneider: The fine structure of the larynx muscles in female tree frogs, Hyla a. arborea L. (Anura, Amphibia). In: Cell and Tissue Research, Band 152, 1974, S. 185–191.
- Rolf Manz: Die Fusionsfrequenzen der Kehlkopfmuskeln und eines Beinmuskels in Abhängigkeit von der Temperatur bei europäischen Froschlurchen (Anura). In: Zoologische Jahrbücher, Abteilung allgemeine Zoologie und Physiologie, Band 79, 1975, S. 221–245.
- Erich Rüth, Hans Schneider: Der Einfluß der Körpertemperatur auf die Herzefrequenz einiger europäischer Froschlurche. In: Pflügers Archiv, Band 337, 1972, S. 45–52.
- Christoph Riegler: Europäischer Laubfrosch - Hyla arborea (LINNAEUS, 1758) bei herpetofauna.at, Amphibien und Reptilien Österreichs, 2002–2015, abgerufen am 3. November 2015
- Laubfrosch soll wieder öfter quaken.
- Susanne Lenné, Hans Schneider: Der Seefrosch in Nordhessen: Nachweis, Rufe, Rufverhalten. In: Hessische Faunistische Briefe, Band 14, 1995, S. 51–62.
- Christophe Dufresnes, Glib Mazepa, Nicolas Rodrigues, Alan Brelsford, Spartak N. Litvinchuk, Roberto Sermier, Guillaume Lavanchy, Caroline Betto-Colliard, Olivier Blaser, Amaël Borzée, Elisa Cavoto, Guillaume Fabre, Karim Ghali, Christine Grossen, Agnes Horn, Julien Leuenberger, Barret C. Phillips, Paul A. Saunders, Romain Savary, Tiziano Maddalena, Matthias Stöck, Sylvain Dubey, Daniele Canestrelli und Daniel L. Jeffries: Genomic evidence for cryptic speciation in tree frogs from the Apennine Peninsula, with description of Hyla perrini sp. nov. Frontiers in Ecology and Evolution 6: 144. Oktober 2018, doi: 10.3389/fevo.2018.00144
- Europäischer Laubfrosch bei www.wisia.de
- Bundesamt für Naturschutz (Hrsg.): Rote Liste der gefährdeten Tiere, Pflanzen und Pilze Deutschlands 1: Wirbeltiere. Landwirtschaftsverlag, Münster 2009, ISBN 978-3-7843-5033-2
- Online-Übersicht bei www.amphibienschutz.de; inkl. Tabelle mit Roten Listen der Bundesländer
- Hyla arborea in der Roten Liste gefährdeter Arten der IUCN 2008. Eingestellt von: Böhme, W., Kuzmin, S., Tarkhnishvili, D., Ishchenko, V., Tuniyev, B., Papenfuss, T., Anderson, S., Sparreboom, M., Ugurtas, I., Beja, P., Andreone, F., Nyström, P., Schmidt, B., Anthony, B., Ogrodowczyk, A., Ogielska, M., Bosch, J., Vogrin, M., Tejedo, M., Cogalniceanu, D., Kovács, T., Kiss, I., Puky, M., Vörös, J., Lizana, M., Martínez-Solano, I., Salvador, A., García-París, M., Recuero Gil, E., Marquez, R., Cheylan, M. & Haxhiu, I., 2006. Abgerufen am 11. März 2009.
Weblinks
- Fotos des Europäischen Laubfrosches auf www.herp.it
- Information und Fotos bei www.herpetofauna.at
- Informationen bei www.amphibienschutz.de (inkl. Rote Listen D, A, CH, Bundesländer)
- Ein Laubfrosch-Schutzprojekt in Niedersachsen bei www.laubfrosch-hannover.de
- NABU-Projekt zum Schutz des Laubfroschs Im Münsterland "Ein König sucht sein Reich"
- Hörprobe eines Laubfroschrufes