Dinophysis
Dinophysis ist eine Gattung von Dinoflagellaten,[1][2][3] die in tropischen und gemäßigten, küstennahen und ozeanischen Gewässern vorkommen.[4]
| Dinophysis | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
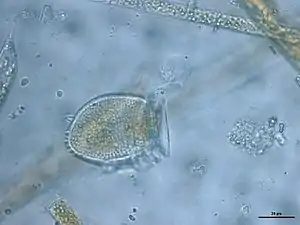
Dinophysis sp. | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Dinophysis | ||||||||||||
| Ehrenberg, 1839 |


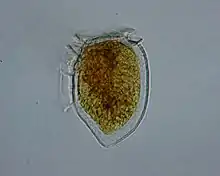
D. acuminata aus der Nordsee
Die Gattung wurde erstmals 1839 von Ehrenberg beschrieben, mit der deutschem Bezeichnung „Krausenthierchen“ und der Holotypus-Spezies (Typusart) Dinophysis acuta Ehrenberg.[5] Die Gattung Dinophysis ist in Kultur nur schwer zu erhalten, was den Erforschung dieser Organismen erschwert.
Die Dinophysis-Individuen sind typischerweise mittelgroße Zellen (30–120 µm)[5] mit der für Dinoflagellaten typischen Panzerung (Theca). Der Bauplan und das thecale Plattenmuster sind innerhalb der Gattung stark konserviert. Die Theca sind durch eine sagittale Spaltnaht (Cingulum, Gürtel) in zwei Hälften (Epitheca bzw. Hypotheca) geteilt. Es gibt in der Gattung fünf Typen von Thecaornamenten, die ein für die Artbestimmung nützliches Merkmal darstellen. Die Dinophysis-Einzeller vermehren sich hauptsächlich durch binäre Spaltung (Schizotomie).[4]
Schwere Ausbrüche von Muschelvergiftungen im Nordosten Japans führten 1976–77 zur Identifizierung der ersten toxinproduzierenden Dinophysis-Art D. fortii (diarrhöische Schalentiervergiftung, englisch diarrhetic shellfish poisoning, DSP).[6]
Die Chloroplasten der photosynthetisch aktiven Arten von Dinophysis sind in der Regel stäbchenförmig oder körnig und gelb oder braun gefärbt.[4] Zumindest einige Dinophysis-Arten nehmen bei der Nahrungsaufnahme die Chloroplasten der Beute auf, die sie eine zeitlang (temporär) behalten (Kleptoplastidie). Beispielsweise nimmt die Art D. caudata diese Kleptoplastiden durch Verschlucken des Wimpertierchens Mesodinium (alias Myrionecta) auf, das seinerseits diese Plastiden von Cryptophyceen der Art Teleaulax amphioxeia „gestohlen“ hat. Daher stammen die Kleptoplastiden dieser Dinophysis-Arten letztlich von den (auch Cryptomonaden genannten) Cryptophyceen, insbesondere von T. amphioxeia.
Etymologie
Der Gattungsnamens stammt aus dem Griechischen, „Dino“ kommt von griechisch δεινός deinos, deutsch ‚schrecklich‘,[7][8] und „-physis“ kommt von φύσις physis, deutsch ‚Natur‘.[9]
Lebensraum und Ökologie
Der übliche Lebensraum von Dinophysis sind tropischen und gemäßigten, ozeanische und küstennahe Gewässer.[4] Obwohl die meisten Dinophysis-Arten Bestandteil des marinen Planktons sind, wurden einige auch in Küstenlagunen und Ästuaren (mit Brackwasser) gefunden.[10][5]
D. caudata ernährt sich von Wimpertierchen (Ciliaten), insbesondere von Mesodinium rubrum (alias Myrionecta rubra) durch Myzozytose. Wahrscheinlich gehören auch Picophytoplankton, mit Bakterien und Cryptophyceen (Cryptomonaden) gehören wahrscheinlich auch zur Ernährung der Dinophysis-Vertreter. In der Kultur werden Dinophysis-Arten mit mixotropher Ernährung gehalten. Obwohl mixotroph, sind sie hauptsächlich phagotroph (räuberische) und die Photosynthese ist mit (dem räuberischen Erwerb von) Kleptoplastiden verbunden, die immer wieder ersetzt werden müssen.[6]
Beschreibung
Morphologie
Die typische Zellgröße von Dinophysis liegt zwischen 30 und 120 µm, es handelt sich also um mittelgroße Zellen.[5] Die Zellgröße von Dinophysis kann dabei von großen, vegetativen Zellen bis hin zu kleinen, gametischen Zellen variieren.[6] Dinophysis haben Theca, die aus zwei großen Platten bestehen und den größten Teil der Panzerung ausmachen, sowie einige kleine Plättchen. Insgesamt zeichnet sich die Gattung 18 Platten aus: vier Epithelplatten, zwei kleine apikale Platten, vier Sulcusplatten, vier Cingulumplatten und vier Hypothecalplatten.[5][6] Sie haben ein Cingulum, das anterior positioniert ist, und die Zellen sind lateral (seitlich) komprimiert.[6] Der Bauplan und die Plattenzusammensetzung der Theca sind innerhalb der Gattung konserviert, die genaue Anordnung der Thecalplättchen ist ein geeignetes Merkmal zur Artbestimmung.[4]Dinophysis-Thecae sind durch eine sagittale „Spaltnaht“ (en. fission suture), das Cingulum, in zwei Hälften geteilt. In der Gattung Dinophysis gibt es fünf Typen von Theca-Ornamentierungen.[4]
Plastide bzw. Kleptoplastide

Charakteristisch für Dinophysis sind winzige, meist stäbchenförmige oder körnige, gelb oder braun gefärbte Chloroplasten. Diese haben Stapel von drei Thylakoiden und ein inneres Pyrenoid. In alternden Zellen neigen die Chloroplasten dazu, in der Mitte zu aggregieren und orangefarbene Flecken zu bilden.[4]
Einige Dinophysis-Arten besitzen offenbar Plastiden, die von Cryptophyceen (Cryptomonaden) stammen, denn sie sind mit denen der Cryptomonaden-Spezies Teleaulax amphioxeia (Geminigera/Plagioselmis/Teleaulax-Komplex) im Wesentlichen identisch.[11] In diesem Fall liegt eine unvollständige Phagocytose (Verschlingung) des Wimpertierchens Mesodinium rubrum, das seinerseits die Cryptomonade verschlingt, wobei jeweils die Plastiden (Chloroplasten) übrig blieben, also Kleptoplastiden sind.[11]
Lange war umstritten, ob die Plastiden von D. caudata permanente oder Kleptoplastiden, also temporäre, sind. Heute ist sicher, dass es sich bei den Plastiden von D. caudata um Kleptoplastiden handelt. Die Diskrepanz zwischen molekularen und ultrastrukturellen Daten der Plastiden ist auf strukturelle Veränderungen während der Aufnahme von Plastiden durch unvollständige Phagocytose zurückzuführen. Wird D. caudata mit den rotbraunen Plastiden von M. rubrum gefüttert, so werden diese nicht in einer Nahrungsvakuole verdaut, sondern an die Peripherie der Zelle transportiert, wo sie sich mit den übrigen Plastiden vereinigten. Während der Einverleibung der Plastiden kommt es dabei zu einer Veränderung von deren Morphologie: die Thylakoide der M. rubrum-(Klepto-)Plastiden werden unregelmäßig und aufgebläht. Beobachtete Pigmentveränderungen der Plastiden sind auf Photoaktivität zurückzuführen; der Wechsel von schwachem zu starkem Licht beim Fehlen von Beute führt dazu, dass die Plastiden grün werden (Priorität des Chlorophylls).[12]
Die Plastiden der Cryptophyceen sind komplexe Plastiden mit vier Membranen und einem Nucleomorph, d. h. sie sind Produkt einer sekundären Endosymbiose.[13] Zudem geht der Nucleomorph der Cryptophyceen-Plastiden, der bei den Wimpertierchen M. rubrum noch zu finden ist, bei D. caudata verloren.[12] Am Ende erscheinen die Plastiden bei D. caudata sternförmig mit gebündelte Pyrenoide in terminaler Position, und ihre Thylakoidmembranen sind paarweise angeordnet.[12]
Lebenszyklus
Die Dinophysis-Einzeller teilen sich hauptsächlich ungeschlechtlich durch binäre Spaltung.[4]
Lange Zeit glaubte man, dass es bei den Dinophysis-Arten keinen Sexualzyklus (mit geschlechtlicher Fortpflanzung) gibt. Inzwischen ist jedoch klar, dass sich bei D. acuminata und D. acuta Gametenzellen bilden können. Dies wurde festgestellt, als sich kleine, kugelförmige Zellen innerhalb größerer Zellen zu bilden schienen.[6] Zwar ist die Rolle des sexuellen Zyklus bei Dinophysis noch nicht vollständig geklärt, aber nach Untersuchungen an D. acuta und anderen Spezies konnte zumindest ein Modell vorgeschlagen werden, wie dies ablaufen könnte:[14]
Deren Zellen kommen in zwei deutlich unterschiedlichen Größen vor. Bei den kleinen Zellen ist die Theca in der Regel dünner als bei den großen Zellen, und die morphologischen Strukturen scheinen weniger entwickelt. Sowohl kleine als auch große Zellen teilten sich vegetativ und bildeten die beobachteten 1 bis 4 rundlichen intrazellulären Körper. Einige dieser rundlichen Körper enthalten wiederum viele kleine begeißelte Zellen (Zoide), die durch eine Pore entkommen und sehr motil sind (d. h. schnell schwimmen). Diese Zoide wachsen wie scheinbar vegetative Formen, fungieren aber später als Gameten: Durch Konjugation (sexuelle Verschmelzung) entsteht eine Zygote, die (manchmal nach einer oder zwei weiteren Teilungen) in eine unbewegliche Zyste übergeht. Diese Arbeitshypothese bedarf jedoch noch weiterer Aufklärung und Bestätigung durch verschiedene Ansätze.[14][6]
Pseudogene
Während toxische (Toxine produzierende) Dinophysis-Arten wie D. acuminata ein einziges Gen für die LSU-rRNA besitzen, scheinen nicht-toxische Arten zwei verschiedene Klassen von LSU-rRNA zu haben. Der Unterschied zwischen diesen beiden Gruppen ist eine Deletion von 70 bp (Basenpaaren), was darauf hindeutet, dass das kürzere Produkt ein Pseudogen ist. Das Pseudogen kann als Marker für D. acuminata verwendet werden und könnte als Marker zur Unterscheidung toxischer und nicht-toxischer Stämme dienen und weitere Erkenntnisse über die Genetik der Toxizität von Dinophysis-Arten liefern.[15]
Praktische Bedeutung
Toxische (Toxine produzierende) Dinophysis-Arten sind eine Bedrohung für die Muschelzucht. Mindestens sieben Dinophysis-Arten enthalten diarrhöische lipophile Muschelgifte.[6] Die toxischen Dinophysis-Arten produzieren Okadasäure, Dinophysistoxine[16] und Pectenotoxine,[17] die die Proteinphosphatase hemmen und Durchfall (Diarrhoe) verursachen.[6] Diese Toxine sind sekundäre Stoffwechselprodukte und eine einzige Art kann durchaus mehrere Arten von Toxinen produzieren. Die Produktion dieser Toxine wird sowohl durch genetische Faktoren als auch durch die Umwelt gesteuert. Die meisten Dinophysis-Arten, die diarrhöische Muschelvergiftungen verursachen, kommen in den borealen, sowie gemäßigten und tropischen Meeren vor. Zu den gemeinsamen Merkmalen toxischer Dinophysis-Arten gehören großes Zellvolumen, stark entwickelte Körpermerkmale (Cingulum, Sulcus, Hypothecalfortsätze).[6]
Systematik
Evolution
Dinoflagellaten werden informell (nicht-taxonomisch) als Algen klassifiziert und bilden nach neueren phylogenetischen Untersuchungen eine Schwestergruppe der Wimpertierchen (Ciliaten) und Apicomplexa. Phylogenetische Untersuchungen wurden meistens anhand von Sequenzen der großen und kleinen ribosomalen Untereinheiten (LSU-rRNA und SSU-rRNA) durchgeführt. Diese Ergebnisse stimmen nicht immer mit morphologischen Untersuchungen auf der Grundlage der Muster der Thecalplatten überein. Die Sequenzierung der SSU-rRNA der Spezies D. acuminata, D. norvegica und D. acuta ergab eine sehr große Übereinstimmung, was darauf hindeutet, dass diese photosynthetischen Arten sich erst vor erdgeschichtlich kurzer Zeit auseinanderentwickelt haben.[15]
Arten
Es hat sich zudem herausgestellt, dass es sich bei vielen verschiedenen Dinophysis-Arten möglicherweise nur um unterschiedliche Lebensphasen derselben Spezies handelt, was zu vielen Synonymisierungen geführt hat. Die folgende Liste führt lediglich eine kurze Auswahl an Spezies der Gattung an:[1][2][3]
- Dinophysis acuminata Claparède & Lachmann, 1859[6][14][15]
- Dinophysis acuta Ehrenberg, 1839 (Typus)[6][14][15]
- Dinophysis caudata Saville-Kent, 1881[18][6][13][12]
- Dinophysis fortii Pavillard, 1924[6] mit Synonym Dinophysis ovum Schütt, 1895 sensu Martin, 1929 (WoRMS)
- Dinophysis hastata Stein, 1883[19]
- Dinophysis norvegica Claparède & Lachmann, 1859[15]
- Dinophysis oviformis Chen & Ni, 1988
- Dinophysis ovum – unter diesem Namen finden sich in den einschlägigen Datenbanken unterschiedliche Einträge:
- Dinophysis ovum (F.Schütt) T.H.Abé (WoRMS) mit Schreibvariante Dinophysis ovum (F. Schütt) T.H. Ab (NCBI)
- Dinophysis ovum F.Schütt 1895 mit Synonym Dinophysis brevisulcus L.-S.Tai & Skogsberg 1934 (AlgaeBase)
- Dinophysis ovum T.H.Abé, nom. illeg. 1967 (AlgaeBase)
- Dinophysis sacculus Stein, 1883 mit Synonym Dinophysis pavillardi J.L.B.Schröder[14]
Literatur und Weblinks
- Awatef Aissaoui, Amel Dhib, Beatriz Reguera, Oum Khaltoum, Ben Hassine, Souad Turki, Lotfi Aleya: First evidence of cell deformation occurrence during a Dinophysis bloom along the shores of the Gulf of Tunis (SW Mediterranean Sea). In: Harmful Algae. 39, Oktober 2014, S. 191–201. doi:10.1016/j.hal.2014.07.017.
- Laura Brooke Harred, Lisa Campbell: Predicting harmful algal blooms: a case study with Dinophysis ovum in the Gulf of Mexico. In: Journal of Plankton Research. 36, Nr. 6, 27. Juli 2014, S. 1434–45. doi:10.1093/plankt/fbu070.
- Moira McCarthy, John O'Halloran, Nora M. O'Brien, Frank F. N. A. M. van Pelt: Does the marine biotoxin okadaic acid cause DNA fragmentation in the blue mussel and the pacific oyster?. In: Marine Environmental Research. 101, Oktober 2014, S. 153–160. doi:10.1016/j.marenvres.2014.09.009. PMID 25440785.
- Beatriz Reguera, Pilar Riobó, Francisco Rodríguez, Patricio A. Díaz, Gemita Pizarro, Beatriz Paz, José M. Franco, Juan Blanco: Dinophysis Toxins: Causative Organisms, Distribution and Fate in Shellfish. In: MDPI Marine Drugs. 12, Nr. 1, 20. Januar 2014, S. 396–461. doi:10.3390/md12010394. PMID 24447996. PMC 3917280 (freier Volltext).
- Aristidis Vlamis, Panagiota Katikou: Climate influence on Dinophysis spp. spatial and temporal distributions in Greek coastal water. In: Plankton & Benthos Research. 9, Nr. 1, März 2014, S. 15–31. doi:10.3800/pbr.9.15.
- Callum Whyte, Sarah Swan, Keith Davidson: Changing wind patterns linked to unusually high Dinophysis blooms around the Shetland Islands, Scotland. In: Harmful Algae. 39, Oktober 2014, S. 365–373. doi:10.1016/j.hal.2014.09.006.
- María García-Portela, Beatriz Reguera, Manoella Sibat, Andreas Altenburger, Francisco Rodríguez, Philipp Hess: Metabolomic Profiles of Dinophysis acuminata and Dinophysis acuta Using Non-Targeted High-Resolution Mass Spectrometry: Effect of Nutritional Status and Prey. In: MDPI Marine Drugs, Band 16, Nr. 5, 26. April 2018, S. 143; doi:10.3390/md16050143
Einzelnachweise
- AlgaeBase: Dinophysis Ehrenberg, 1839
- NCBI: Dinophysis Ehrenberg, 1839 (genus); graphisch: Dinophysis, auf: Lifemap NCBI Version.
- WoRMS: Dinophysis Ehrenberg, 1839
- Gustaaf Marinus Hallegraeff, I. A. N. Lucas: The marine dinoflagellate genus Dinophysis (Dinophyceae): Photosynthetic, neritic and non-photosynthetic, oceanic species, in: Phycologia, Band 27, Nr. 1, März 1988, S. 25–42, doi:10.2216/i0031-8884-27-1-25.1, Epub 6. März 2019
- Christian Gottfried Ehrenberg: Über noch zahlreich jetzt lebende Thierarten der Kreidebildung, nach Vorträgen in der Akademie der Wissenschaften zu Berlin in den Jahren 1839 und 1840, L. Voss, Leipzig. PDF, S. 44ff: Dinophysis Krausenthierchen
- Beatriz Reguera, Lourdes Velo-Suárez, Robin Raine, Myung Gil Park: Harmful Dinophysis species: A review. Harmful Algae, in: Harmful Algae, Band 14, Februar 2012, S. 87–106, doi:10.1016/j.hal.2011.10.016
- Δεινός Wiktionary
- dinosaur (n.), Online Etymology Dictionary
- Physis Wiktionary
- Seetharamaiah Thippeswamy, Malathi Shettigar: Plankton Diversity in Indian Estuaries-A review, in: Plankton dynamics of Indian waters, S. 306–333, Januar 2009, Daya Publishing House, Jaipur, Indien
- Sven Janson, Edna Granéli: Genetic analysis of the psbA gene from single cells indicates a cryptomonad origin of the plastid in Dinophysis (Dinophyceae), in: Phycologia, Band 42, Nr. 5, S. 473–477, Februar 2003, doi:10.2216/i0031-8884-42-5-473.1, Epub 6. März 2019
- Miran Kim, Seung Won Nam, Woongghi Shin, D. Wayne Coats, Myung Gil Park: Dinophysis caudata (Dinophyceae) sequesters and retains plastids from the mixotrophic ciliate prey Mesodinium Rubrum, in: Journal of Phycology, Band 48, Nr. 3, S. 569–579, 24. März 2012, doi:10.1111/j.1529-8817.2012.01150.x
- Jong Im Kim, Hwan Su Yoon, Gangman Yi, Hyung Seop Kim, Wonho Yih, Woongghi Shin: The Plastid Genome of the Cryptomonad Teleaulax amphioxeia, in: PLoS One, Band 10, Nr. 6, 5. Juni 2015, doi:10.1371/journal.pone.0129284
- Brigitte R. Berland, Serge Y. Maestrini, Daniel Grzebyk: Observations on possible life cycle stages of the dinoflagellates Dinophysis cf. acuminata, Dinophysis acuta and Dinophysis pavillardi, in: Aquatic Microbial Ecology (AME), Band 9, Nr. 2, S. 183–189, 31. August 1995, doi:10.3354/ame009183, ResearchGate
- Ann-Sofi Rehnstam-Holm, Anna Godhe, Donald M. Anderson: Molecular studies of Dinophysis (Dinophyceae) species from Sweden and North America, in: Phycologia, Band 41, Nr. 4, Juli 2002, S. 348–357, doi:10.2216/i0031-8884-41-4-348.1, ResearchGate, Epub 22. April 2019
- Dinophysistoxin, spektrum.de Lexikon der Biologie
- Zhaoxin Li, Guo Mengmeng, Yang Shouguo, Wang Qingyin, Tan Zhijun: Investigation of Pectenotoxin Profiles in the Yellow Sea (China) Using a Passive Sampling Technique, in: MDPI Marine Drugs, Band 8, Nr. 4, S. 1263–1272, Special Issue Algal Toxins, 15. April 2010, doi:10.3390/md8041263
- M. A. Faust, R. A. Gulledge: Dinophysis caudata Saville-Kent, 1881, auf: Marine Species Identification Portal (Key of Nature): Marine Species: Harmful Marine Dinoflagellates
- Fatima Santos: Dinophysis hastata Stein, 1883, Whole cell of the dinoflagellate Dinophysis hastata, Bild auf: plankton net