Saxitoxin
Saxitoxin (STX) ist neben seinen verwandten Verbindungen Neosaxitoxin (NSTX, NEO, neoSTX) und Gonyautoxin (GTX) ein wichtiger Hauptvertreter von Neurotoxinen (Nervengifte), die in Miesmuscheln, Pfahlmuscheln oder Austern angereichert sein können und bei deren Verzehr durch den Menschen eine Muschelvergiftung (Mytilismus), die als paralytic shellfish poisoning (PSP) bekannt ist, verursachen können. Daher wird die Gruppe dieser Gifte auch PSP-Toxine genannt. Quelle der Toxine sind vor allem Dinoflagellaten, die als Teil des Planktons insbesondere von Muscheln als Nahrung aufgenommen werden. Aber auch hauptsächlich im Süßwasser vorkommende Cyanobakterien sind in der Lage, Saxitoxine zu synthetisieren.[4] Zu den saxitoxinproduzierenden Dinoflagellaten zählen unter anderem:
- Alexandrium catenella (Gonyaulax catenella)
- Alexandrium tamarense excavatum (Gonyaulax tamarensis)
- Pyrodinium bahamense.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
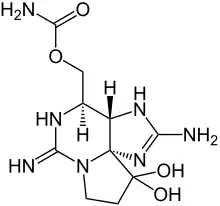 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Saxitoxin | |||||||||||||||
| Andere Namen |
STX | |||||||||||||||
| Summenformel | C10H17N7O4 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 299,29 g·mol−1 | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Diese vermehren sich insbesondere in den warmen Jahreszeiten und können rasch rötlich gefärbte Algenteppiche in Küstengebieten ausbilden („red tide“).[5]
Saxitoxin kann sowohl durch Inhalation (Einatmen), über offene Wunden als auch über die Nahrungsaufnahme in den Körper gelangen. Aufgenommenes Saxitoxin kann innerhalb von Minuten bis wenigen Stunden zu einer tödlichen Atemlähmung führen. Nicht tödliche Dosen führen beim Menschen nach wenigen Stunden zu folgenden Symptomen: Übelkeit, Erbrechen, Diarrhoe, Bauchschmerzen, Muskelschmerzen und Kopfschmerzen. Es treten Missempfindungen und Sehstörungen auf.[6] Die tödliche Dosis variiert zwischen 0,5 und 12,4 mg Saxitoxin für einen erwachsenen Menschen (eine zu 50%-letale Dosis (LD50 oral) für den Menschen wird mit ab 5,7 µg/kg Körpergewicht angegeben).[7][8]
Saxitoxin als chemischer Kampfstoff
Saxitoxin war unter der Bezeichnung TZ aufgrund seiner hohen Giftigkeit immer wieder als chemischer Kampfstoff im Gespräch. Es gibt Berichte, denen zufolge es möglich sein soll, Gewehrmunition mit Saxitoxin zu kontaminieren, um eine rasche tödliche Wirkung zu erzielen. Saxitoxin ist etwa 1000-mal giftiger als das synthetische Nervengift Sarin und ist wie Ricin ein Kampfstoff biologischer Herkunft. Die US-amerikanische CIA soll in den 50er-Jahren für ihre Agenten (z. B. U-2-Pilot Gary Powers) Giftkapseln mit Saxitoxin hergestellt haben. Saxitoxin steht auf der Kriegswaffenliste des bundesdeutschen Kriegswaffenkontrollgesetzes.[9]
Saxitoxin in der medizinischen Forschung
Wie das Tetrodotoxin ist Saxitoxin (STX) in der medizinischen Forschung eine wichtige Substanz: Es gilt als selektiver Natriumkanal-Blocker, der keinen Einfluss auf den Flux von Chlorid- oder Kaliumionen der Zellmembran hat. Die erste ausführliche chemische Analyse und Synthese des Saxitoxins stammt von Yoshito Kishi im Jahre 1977.[10][11]
Analytik
Saxitoxin kann nach hinreichender Probenvorbereitung[12] durch Einsatz der Kopplung der HPLC mit der Massenspektrometrie in den unterschiedlichen Untersuchungsmaterialien wie z. B. Plasma oder Urin qualitativ und quantitativ nachgewiesen werden.[13][14] Auch für die Untersuchung von Muscheln[12] oder Fischen[15] können die oben genannten Verfahren eingesetzt werden.
Saxitoxin-Derivate, Paralytic Shellfish (Poisoning) Toxine (PSTs, PSP-Toxine)
PSP-Toxine beschreibt eine Gruppe von Toxinen, die sich von der Grundstruktur des Saxitoxins ableiten. PSP-Toxine blockieren spannungsabhängige Natriumkanäle der Nervenzellen. Dadurch wird die Reizweiterleitung in den Nervenfasern und die Kontraktion von Skelettmuskeln gehemmt, es kommt zu einer Lähmung (Paralyse). Saxitoxin weist eine vergleichsweise hohe Toxizität auf und wird als Leitsubstanz zur Toxizitätsbestimmung der verwandten Verbindungen verwendet.
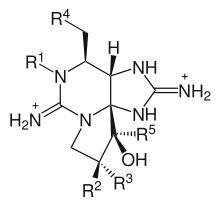
- Die wichtigsten verwandten Verbindungen unterscheiden sich an den chemischen Resten (R1-R5, siehe Abbildung „Saxitoxin-Derivate“). Die Hauptunterteilung der Toxine wird durch den chemischen Rest an Position 4 (R4) bestimmt. An R4 mit Carbamoyl-Gruppe (Carbamate): Neosaxitoxin, Gonyautoxin (I bis IV); an R4 mit N-sulfo-carbanoyl-Gruppe (Sulfamate): Gonyautoxin (V und VI), C-Toxine (I bis IV); an R4 mit Hydroxygruppe: Decarbamoyl-Saxitoxin, Decarbamoyl-Gonyautoxin (I bis IV), Decarbamoyl-Neosaxitoxin; an R4 protoniert (Wasserstoffatom, H): Deoxydecarbamoyl-Saxitoxin, Deoxydecarbamoyl-Gonyautoxin (II und III). Des Weiteren werden spezielle Toxine der Spezies Lyngbya wollei (LWTX-Toxine I bis VI) mit einer Methylgruppe (verestert) an R4 und Gymnodinium catenatum (GC-Toxine I bis III) mit einem Phenolrest (verestert) an R4 genannt. Die chemischen Reste R1, R2, R3 und R5 unterscheiden sich durch unterschiedliche Kombinationen einer Hydroxygruppe, eines Wasserstoffatoms oder einer Organosulfatgruppe.[3][16]
- Ein Saxitoxinderivat, das eine höhere toxische Potenz als das Saxitoxin selbst aufweist ist z. B. das Zetekitoxin.[3][17]
Siehe auch
Weblinks
- Saxitoxin in der Dinoflagellaten Art Gonyaulax catenella
- PSP in Alaska (PDF; 1,4 MB) uaf.edu (englisch)
- scinexx.de
- Factsheet Saxitoxin (Mytilotoxin; Shellfish Toxine; STX, PSP). (PDF, 213 kB) Labor Spiez
Einzelnachweise
- Datenblatt bei CbInfo (Memento des Originals vom 14. Oktober 2007 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Saxitoxin im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 13. März 2019.
- Lyndon E. Llewellyn: Saxitoxin, a toxic marine natural product that targets a multitude of receptors. In: Natural Product Reports. Band 23, Nr. 2, 2013, S. 200–222, doi:10.1039/B501296C.
- J. D. Hackett, J. H. Wisecaver, M. L. Brosnahan, D. M. Kulis, D. M. Anderson, D. Bhattacharya, F. G. Plumley, D. L. Erdner: Evolution of saxitoxin synthesis in cyanobacteria and dinoflagellates. In: Mol Biol Evol., 30(1), Jan 2013, S. 70–78. PMID 22628533.
- J.P. Parkhill, A.D. Cembella: Effects of salinity, light and inorganic nitrogen on growth and toxigenicity of the marine dinoflagellate Alexandrium tamarense from northeastern Canada. In: Journal of Plankton Research. Band 21, Nr. 5, 1999, S. 939–955, doi:10.1093/plankt/21.5.939.
- A. Schrader, O. Strubelt, G. Wagner, F. Amelung: Tierische Gifte. In: A. Schrader (Hrsg.): Toxisch bedingte Krankheiten des Nervensystems. Springer-Verlag, Berlin / New York 1992, S. 229–263, Bereich D: Saxitoxin-Intoxikation, S. 256.
- S. Faber: Saxitoxin and the induction of paralytic shellfish poisoning. In: Journal of Young Investigators. Band 23, Nr. 1, 2012, S. 1–7 (jyi.org).
- J. Patocka, L. Stredav: Brief Review of Natural Nonprotein Neurotoxins. In: Richard Price (Hrsg.): ASA Newsletter. (Applied Science and Analysis inc.) 02–2 (89), 23. April 2002, S. 16–23. ISSN 1057-9419.
- Kriegswaffenliste des Gesetzes über die Kontrolle von Kriegswaffen
- H. Tanino, T. Nakata, T. Kaneko, Y. Kishi: A stereospecific total synthesis of dl-saxitoxin. In: Journal of the American Chemical Society, 99, 1977, S. 2818, doi:10.1021/ja00450a079.
- Synthesis of Saxitoxin. synarchive.com; abgerufen am 16. August 2017.
- K. Harju, M. L. Rapinoja, M. A. Avondet, W. Arnold, M. Schär, S. Burrell, W. Luginbühl, P. Vanninen: Optimization of Sample Preparation for the Identification and Quantification of Saxitoxin in Proficiency Test Mussel Sample using Liquid Chromatography-Tandem Mass Spectrometry. In: Toxins. (Basel). 7(12), 25. Nov 2015, S. 4868–4880. PMID 26610567
- R. W. Peake, V. Y. Zhang, N. Azcue, C. E. Hartigan, A. Shkreta, J. Prabhakara, C. B. Berde, M. D. Kellogg: Measurement of neosaxitoxin in human plasma using liquid-chromatography tandem mass spectrometry: Proof of concept for a pharmacokinetic application. In: J Chromatogr B Analyt Technol Biomed Life Sci., 1036–1037, 1. Okt 2016, S. 42–49. PMID 27710889
- W. A. Bragg, S. W. Lemire, R. M. Coleman, E. I. Hamelin, R. C. Johnson: Detection of human exposure to saxitoxin and neosaxitoxin in urine by online-solid phase extraction-liquid chromatography-tandem mass spectrometry. In: Toxicon, 99, 1. Jun 2015, S. 118–124. doi:10.1016/j.toxicon.2015.03.017 Epub 2015 Mar 27. PMID 25817003
- T. Nakatani, M. Shimizu, T. Yamano: The Contents and Composition of Tetrodotoxin and Paralytic Shellfish Poisoning Toxins in Marine Pufferfish Canthigaster rivulata. In: Shokuhin Eiseigaku Zasshi, 57(2), 2016, S. 51–56. PMID 27211919.
- Brenton Nicholson, John Papageorgiou, Andrew E. Humpage, Paul Monis, Dennis Steffensen: Determination and Significance of Emerging Algal Toxins (Cyanotoxins). American Water Works Association, 2007, ISBN 978-1-58321-536-4, S. 50 (eingeschränkte Vorschau in der Google-Buchsuche).
- M. Yotsu-Yamashita, Y. H. Kim, S. C. Dudley Jr, G. Choudhary, A. Pfahnl, Y. Oshima, J. W. Daly: The structure of zetekitoxin AB, a saxitoxin analog from the Panamanian golden frog Atelopus zeteki: a potent sodium-channel blocker. In: Proceedings of the National Academy of Sciences. Band 101, Nr. 13, 2013, S. 4346–4351, doi:10.1073/pnas.0400368101.
