Brevetoxine
Brevetoxine (Ptychodiscus-Toxine, PbTx) sind neurotoxische Algengifte der Dinoflagellaten der Spezies Karenia. Namensgeber der Toxine ist Karenia brevis (früher Gymnodinium breve und Ptychodiscus brevis).[1][2] Brevetoxine sind geschmacklos, geruchlos, Säure- und Hitzestabil (bis 300 °C).[1][3]
Vorkommen und Bedeutung

Karenia brevis ist eine marine Alge und Bestandteil des Phytoplanktons tropischer Regionen und wird regelmäßig in der Karibik und insbesondere im Golf von Mexiko beobachtet. Hier tritt sie als einer der Verursacher von “Red Tides”, sogenannten Roten Tiden (rote Algenblüte), die sich durch massenhafte Vermehrung dieser Algen bilden, auf. Im Zuge solcher “Red Tides” kommt es immer wieder zum Massensterben von Fischen und Tieren höherer Trophieebenen (z. B. Delfine) verursacht durch giftige Stoffwechselprodukte der Algen, insbesondere durch Brevetoxine. Neben der Giftwirkung ist jedoch auch die Reduktion des Sauerstoffgehalts, der durch die hohe Dichte an Phytoplankton an der Wasseroberfläche verursacht wird, am Massensterben beteiligt.[4]
Innerhalb der Nahrungskette kann es zu einer Anreicherung der Brevetoxine kommen. Dies führt dazu, dass toxinbelastete Fische, Muscheln, Krebse ihren Weg zum Menschen als Endglied solcher Nahrungsketten finden. Beim Menschen wird die Vergiftung als Neurotoxic Shellfish Poisoning (NSP) bezeichnet.[4]
Struktur und Eigenschaften
Brevetoxine gehören zu den reduzierten nicht-aromatischen Polyketiden. Es handelt sich um einen Polyether, die Anwesenheit von Tetrahydrofuran- und/oder Tetrahydropyranringen ist charakteristisch für diese Polyketide. Auch besitzen diese mehrere Etherbindungen. Derzeit sind zehn verschiedene Brevetoxine bekannt, die sich in die Gruppen A und B unterteilen lassen. Die Brevetoxine A haben zehn fünf- bis neungliedrige Ringe, B elf fünf- bis achtgliedrige Ringe.
| Brevetoxin A | Brevetoxin B | |
|---|---|---|
| Strukturformel | 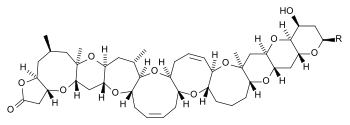 Brevetoxin A |
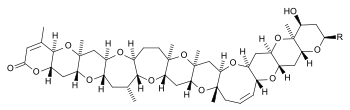 Brevetoxin B |
| Subtypen |
|
|
Weitere Brevetoxine:
- Brevetoxin-5 (PbTx-5): wie PbTx-3, jedoch ist die Hydroxygruppe in Position 38 acetyliert
- Brevetoxin-6 (PbTx-6): wie PbTx-2, an Stelle der Doppelbindung 27–28 findet sich ein Epoxid
Die Strukturaufklärung wie auch die Totalsynthese dieser Toxine war kein leichtes Unterfangen. 1981 wurde Brevetoxin B als erstes dieser Gifte in seiner Struktur aufgeklärt[5]; 1995 publizierten Nicolaou et al.[6][7][8][9][10] dessen Totalsynthese. Brevetoxin A wurde 1986 in seiner Struktur aufgeklärt[11] und 1998, wiederum von Nicolaou et al.[12], erstmals totalsynthetisiert.
Toxizität
Brevetoxine sind Neurotoxine, welche eine Reizung der Schleimhäute und Atemwege verursachen. Die Wirkung ähnelt dem von Ciguatoxin, aber sie sind weniger toxisch. Es bindet an spannungsabhängige Natriumkanäle und führt so zu einer Depolarisation von Nerven- und Muskelzellen und schließlich zu einer Reizweiterleitung und Aktivierung dieser Zellen. Zudem verlängern sie die Depolarisationsphase durch eine Hemmung der Inaktivierung des Natriumkanals.
Nicht nur beim Baden besteht die Gefahr der Vergiftung (insbesondere durch das Einatmen von toxinhaltigen Aerosolen). In den Restaurants kann mit Brevetoxinen verseuchter Fisch die neurotoxische Muschelvergiftung (Neurotoxic Shellfish Poisoning, NSP) hervorrufen. Neben Magen-Darm-Beschwerden treten Kribbeln an Lippen und an den Extremitäten, Schwindel und Koordinationsstörungen auf. Der Herzschlag wird verlangsamt (Bradykardie). Ebenso sind Heiß-Kalt-Missempfindungen möglich.[4] Aufgrund der Reizung der Atemwege und der Toxizität gegenüber der körpereigenen Abwehr (Immunsystem) besteht besonders bei Personen mit Atemwegserkrankungen (z. B. Asthma, Bronchitis) die Gefahr der Verschlechterung von Symptomen.[1]
Die Vergiftung mit Brevetoxin gilt als relativ harmlos und hinterlässt keine dauerhaften Schäden. In-vitro-Untersuchungen von John Ramsdell von der National Oceanic and Atmospheric Administration (NOAA) in Charleston/South Carolina zeigten, dass eines der untersuchten Toxine sehr wohl bleibende Schäden verursachen kann. Es bindet an der DNA und bildet DNA-Addukte, die Mutationen und Fehler in der Zellteilung hervorrufen können. So stuft man sie als möglicherweise karzinogen ein. Nach Ansicht der NOAA ist es jedoch zu früh, dies sicher sagen zu können, denn es besteht die Möglichkeit, dass körpereigene Reparaturenzyme die Fehler wieder beseitigen.[13]
Die Substanz Brevenal ist ein Antagonist der Brevetoxine. Es bindet an einer anderen Stelle des Natriumkanals und verdrängt dabei das Brevetoxin. Dadurch wird die toxische Wirkung des Toxins gehemmt.[4] Brevenal wird ebenfalls von Karenia brevis produziert.[1]
Brevetoxine stellen auch ein starkes Fischgift (Ichthyotoxin) dar.[3]
Verwandte Verbindungen
Die Yessotoxine (YTX) sind eine Gruppe lipophiler schwefelhaltiger Polyketide, die mit Ciguatoxinen verwandt sind und den Brevetoxine ähneln.[2][14] Sie werden von einer Vielzahl von Dinoflagellaten produziert, insbesondere von Lingulodinium polyedrum und Gonyaulax spinifera. Wenn die Umgebungsbedingungen das Wachstum von YTX-produzierenden Dinoflagellaten fördern, akkumulieren die Toxine in der Nahrungskette.[15] Dies führt dazu, dass toxinbelastete Fische, Muscheln, Krebse ihren Weg zum Menschen als Endglied solcher Nahrungsketten finden. Beim Menschen wird die Vergiftung als Diarrhetic shellfish Poison (DSP) bezeichnet.[2] Der IC50-Wert verschiedener YTX-Derivate liegt bei ungefähr 0,5 nM.[2]
Siehe auch
Einzelnachweise
- L. E.Fleming, B. Kirkpatrick, L. C. Backer, C. J. Walsh, K. Nierenberg, J. Clark: Review of Florida Red Tide and Human Health Effects. In: Harmful algae. 10, Nr. 2, 2011, S. 224–233. doi:10.1016/j.hal.2010.08.006.
- Jean-Michel Kornprobst: Encyclopedia of Marine Natural Products. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany 2014, ISBN 978-3-527-33585-5, S. 246, doi:10.1002/9783527335855 (wiley.com [abgerufen am 11. Juni 2019]).
- D. G. Baden: Brevetoxins: unique polyether dinoflagellate toxins. In: The FASEB Journal. 3, Nr. 7, 1989, S. 1807–1817.
- R. H. Pierce, M. S. Henry: Harmful algal toxins of the Florida red tide (Karenia brevis): natural chemical stressors in South Florida coastal ecosystems. In: Ecotoxicology (London, England). 17, Nr. 7, 2011, S. 623–631. doi:10.1007/s10646-008-0241-x.
- Yong-Yeng Lin, Martin Risk, Sammy M. Ray, Donna Van Engen, Jon Clardy, Jerzy Golik, John C. James, Koji Nakanishi: Isolation and Structure of Brevetoxin B from the „Red Tide“ Dinoflagellate Ptychodiscus brevis (Gymnodinium breve). In: Journal of the American Chemical Society. Bd. 103, Nr. 22, 1981, S. 6773–6775, doi:10.1021/ja00412a053.
- K. C. Nicolaou, E. A. Theodorakis, F. P. J. T. Rutjes, J. Tiebes, M. Sato, E. Untersteller, X.-Y. Xiao: Total Synthesis of Brevetoxin B. 1. CDEFG Framework. In: Journal of the American Chemical Society. Bd. 117, Nr. 3, 1995, S. 1171–1172, doi:10.1021/ja00108a051.
- K. C. Nicolaou, F. P. J. T. Rutjes, E. A. Theodorakis, J. Tiebes, M. Sato, E. Untersteller: Total Synthesis of Brevetoxin B. 2. Completion. In: Journal of the American Chemical Society. Bd. 117, Nr. 3, 1995, S. 1173–1174, doi:10.1021/ja00108a052.
- K. C. Nicolaou, C.-K. Hwang, M. E. Duggan, D. A. Nugiel, Y. Abe, K. Bal Reddy, S. A. DeFrees, D. R. Reddy, R. A. Awartani, S. R. Conley, F. P. J. T. Rutjes, E. A. Theodorakis: Total Synthesis of Brevetoxin B. 1. First Generation Strategies and New Approaches to Oxepane Systems. In: Journal of the American Chemical Society. Bd. 117, Nr. 41, 1995, S. 10227–10238, doi:10.1021/ja00146a008.
- K. C. Nicolaou, E. A. Theodorakis, F. P. J. T. Rutjes, M. Sato, J. Tiebes, X.-Y. Xiao, C.-K. Hwang, M. E. Duggan, Z. Yang, E. A. Couladouros, F. Sato, J. Shin, H.-M. He, T. Bleckman: Total Synthesis of Brevetoxin B. 2. Second Generation Strategies and Construction of the Dioxepane Region [DEFG]. In: Journal of the American Chemical Society. Bd. 117, Nr. 41, 1995, S. 10239–10251, doi:10.1021/ja00146a009.
- K. C. Nicolaou, F. P. J. T. Rutjes, E. A. Theodorakis, J. Tiebes, M. Sato, E. Untersteller: Total Synthesis of Brevetoxin B. 3. Final Strategy and Completion. In: Journal of the American Chemical Society. Bd. 117, Nr. 41, 1995, S. 10252–10263, doi:10.1021/ja00146a010.
- Y. Shimizu, H.-N. Chou, H. Bando, G. Van Duyne, J. C. Clardy: . In: J. Am. Chem. Soc. 108, 514 (1986).
- K. C. Nicolaou, Zhen Yang, Guo-qiang Shi, Janet L. Gunzner, Konstantinos A. Agrios, Peter Gärtner: Total synthesis of brevetoxin A. In: Nature. Vol. 392, Nr. 6673, 1998, S. 264–269, doi:10.1038/32623.
- Peter Nuhn, Ludger Wessjohann: Naturstoffchemie. Mikrobielle, pflanzliche und tierische Naturstoffe. 4., neu bearbeitete Auflage. Hirzel, Stuttgart 2006, ISBN 3-7776-1363-0, S. 335.
- A. Tubaro, V. Dell’Ovo, S. Sosa, C. Florio: Yessotoxins: A Toxicological Overview. In: Toxicon. 56, Nr. 2, 2010, S. 163–172. doi:10.1016/j.toxicon.2009.07.038. PMID 19660487.
- M. D. A. Howard, M. Silver, R. M. Kudela: Yessotoxin detected in mussel (Mytilus californicus) and phytoplankton samples from the U.S. west coast. In: Harmful Algae. 7, Nr. 5, 2008, S. 646–652. doi:10.1016/j.hal.2008.01.003.