Euglenida
Die Euglenida bilden eine Klasse eukaryotischer Einzeller mit etwa 1000 bekannten Arten, die weltweit verbreitet und nahezu in jedem Habitat zu finden ist. Die bekannteste Gattung stellen die Augentierchen (Euglena) dar. Sie vereinen tierische und pflanzliche Eigenschaften. Dies resultiert wie bei den Dinoflagellaten und bei den Apicomplexa daher, dass im Zuge einer sekundären Endosymbiose ein Chloroplast von einem Eukaryoten aufgenommen wurde. Der Euglenid hat zusätzlich zu den Membranen des Chloroplasten die Membran des Eukaryoten, der ihn aufgenommen hat.
| Euglenida | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Euglena viridis | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Euglenida | ||||||||||||
| Stein, 1878 |
Verbreitung und Lebensweise
Ein Großteil der Euglenida lebt im flachen Süßwasser, das reich an organischem Material wie abgestorbenen Tieren und Pflanzen ist. Einige Arten leben im Meer (z. B. Eutreptia viridis[1]) oder Brackwasser. Sie besiedeln auch Extremstandorte wie Schnee und Salzseen. Berichte über parasitisch lebende Vertreter der Euglenida[2] konnten nie endgültig bestätigt werden und gelten daher als zweifelhaft.
Unter bestimmten Bedingungen kommen einige Vertreter, zum Beispiel Euglena sanguinea, in so großen Massen vor, dass sie eine Wasserlache rot oder grün anfärben. Man spricht dann von einer Algenblüte.
Die grüne Farbe vieler Arten wird durch Chlorophylle (Chlorophyll a und b) der Chloroplasten verursacht, mit deren Hilfe sie Photosynthese betreiben (phototrophe Ernährung). Photosyntheseprodukte werden als Paramylonkörner gespeichert.
Die Vermehrung erfolgt durch Längsteilung. Der gesamte Vorgang dauert etwa 2 bis 4 Stunden. Eine sexuelle Vermehrung ist bei Euglenida nicht bekannt, es ist möglich, dass sie sich vom Hauptstamm der Protisten getrennt haben, bevor sexuelle Vermehrung entwickelt wurde[3].
Ernährung
Die Ernährung der Euglenida ist sehr vielfältig und ist zum Teil von besonderen zellulären Strukturen abhängig.
Die phototrophen Euglenida besitzen funktionsfähige Chloroplasten mit den Chlorophyllen a und b und betreiben Photosynthese. Dennoch sind auch diese grünen Euglenida nicht vollkommen photoautotroph, da auch sie auf die Aufnahme von gelösten organischen Verbindungen, wie beispielsweise Vitaminen, aus dem umgebenden Medium angewiesen sind. Diese pinocytotische Aufnahme von gelösten Stoffen bezeichnet man als Osmotrophie. Da sich die grünen Euglenida phototroph und osmotroph ernähren, werden sie auch als mixotroph bezeichnet[4].
Die heterotrophen Euglenida besitzen keine funktionsfähigen Chloroplasten und sind daher ausschließlich auf die Aufnahme organischer Substanzen angewiesen. Innerhalb der heterotrophen Euglenida lassen sich wiederum zwei Gruppen unterscheiden: Die phagotrophen Euglenida besitzen spezielle Ingestionsapparate, mit deren Hilfe sie größere Beuteorganismen, wie andere Einzeller aufnehmen können[5]. Anschließend werden diese Nahrungspartikel verdaut. Zu den phagotrophen Euglenida gehören beispielsweise Vertreter der Gattungen Peranema, Entosiphon oder Petalomonas. Aber auch diese Organismen ernähren sich nicht ausschließlich phagotroph, sondern zusätzlich auch osmotroph. Als osmotrophe Euglenoide werden die Organismen bezeichnet, die sich ausschließlich osmotroph ernähren, also weder Photosynthese betreiben, noch über spezialisierte Ingestionsapparate verfügen. Primär osmotrophe Euglenida stammen von phagotrophen Vorfahren ab. Dazu zählen beispielsweise Vertreter der Gattung Distigma[6]. Sekundär osmotrophe Euglenida lassen sich eindeutig auf phototrophe Vorfahren zurückführen. Im Laufe der Evolution ging bei diesen Organismen die Fähigkeit zur Photosynthese verloren. Ein klassisches Beispiel hierfür ist Euglena longa (früher Astasia longa). Bei diesem heterotrophen Organismus konnte man rudimentäre Plastiden nachweisen, die Reste ihrer DNA besitzen, aber keine Photosynthese mehr betreiben.[7]
Aufbau
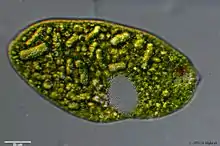
Euglenida haben längliche Zellen mit Wendelstruktur. Sie besitzen meist ein oder zwei Geißeln, mit denen sie schwimmen können. Sie können aber auch auf Oberflächen kriechen.
Die Euglenida besitzen keine Zellwand, sondern eine sogenannte Pellicula (lat. Fellchen), die aus einer Zellmembran und einer darunter liegenden eiweißhaltigen Schicht besteht, die je nach Art unterschiedlich dick sein kann. Darunter befinden sich Mikrotubuli als Zytoskelettelemente.[4] Dadurch ist ihre Oberfläche nicht eben, bei höherer Auflösung sind unter dem Lichtmikroskop spiralige Streifen zu sehen.
Am vorderen Zellende stülpt sich die Pellicula zu einem Kanal-Komplex ein, der auch als Ampulle bezeichnet wird und der Aufnahme von Nährstoffen dient (Zellmund). In ihrer Nähe befindet sich ein pulsierendes Bläschen (kontraktile Vakuole), das überschüssiges Wasser, das durch Osmose aufgenommen wurde, wieder abpumpt.
Die Geißeln entspringen an der Vorderseite der Zelle und verlaufen durch den Reservoir/Kanal-Komplex. Es gibt drei Flagellenwurzeln, sogenannte Basalkörper, jedoch ragen nur ein bis zwei der Geißeln aus der Ampulle heraus. Bei den Arten mit nur einer herausragenden Geißel befindet sich die zweite Geißel verkürzt innerhalb des Kanal-Komplexes. An den Geißeln sind haarartige Eiweißstrukturen, die auch Mastigonemata genannt werden.
Sekundäre Endosymbiose
Lange umstritten war die Frage nach der Herkunft der Chloroplasten phototropher Euglenida. Aus cytologischen und molekularbiologischen Befunden konnte man die folgende Hypothese aufstellen: Zunächst setzte sich das Taxon ausschließlich aus phagotrophen Arten zusammen. Ein Vertreter dieser Gruppe „fraß“ eines Tages eine Grünalge, die jedoch nicht verdaut wurde, sondern in ihm erhalten blieb. Auch im weiteren Verlauf der Entwicklung, während der Vermehrung der Euglenida durch Zellteilung, blieb diese Grünalge erhalten, indem sie sich ebenfalls vermehrte und ihre Nachkommen in den Tochterindividuen fortlebten. Schließlich verloren die Grünalgen einen Teil ihrer Selbständigkeit und wurden als zelleigene Chloroplasten etabliert. Dieser Vorgang wird als sekundäre Endocytobiose bezeichnet, weil nach der Endosymbiontentheorie die Grünalgen selbst schon durch Endosymbiose entstanden sein sollen: Endosymbiontische Cyanobakterien haben sich demnach in Wirtszellen unter Aufgabe eines Teils ihrer Autonomie zu Chloroplasten entwickelt. Die Endosymbiose der Grünalgen in Euglenida ist danach also eine zweite Stufe der Endosymbiose. Für diese Annahme lassen sich viele Hinweise finden: Die Chloroplasten der phototrophen Augentierchen sind von drei Hüllmembranen umgeben und nicht von zwei Membranen wie bei Grünalgen und Pflanzen. Molekularbiologische Untersuchungen zeigen zudem eine nahe Verwandtschaft der Chloroplasten-Gene zu entsprechenden Genen der Grünalgen. Die Euglenida selbst, repräsentiert durch ihre Zellkerne, sind aber eindeutig mit den übrigen, nicht phototrophen Vertretern der Euglenozoa verwandt. Nachdem die Photosynthese innerhalb der Gruppe etabliert war, haben einige dieser phototrophen Arten ihre Chloroplasten wieder reduziert oder komplett verloren. Nur durch molekular-systematische Untersuchungen lassen sich diese Verwandtschaftsverhältnisse rekonstruieren.
Systematik
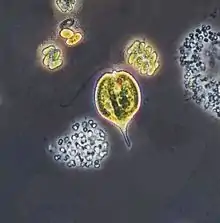
Zusammen mit den Diplonemida, den Kinetoplastida und den Symbiontida werden die Euglenida in den Euglenozoa zusammengefasst.[8] [9]
Innerhalb der Euglenida fand im Verlauf der Evolution eine Aufspaltung statt: Eine Gruppe umfasst die phototrophen und diejenigen heterotrophen Taxa, die ihre Chloroplasten sekundär wieder verloren haben. Zusammen mit Peranema trichophorum, einer Art, die eukaryotische Zellen durch Phagozytose aufnehmen kann, bilden die Taxa dieser Gruppe ein Monophylum.
Die Evolution der zweiten Gruppe verlief unabhängig hiervon. Sie wird aus primär heterotrophen Vertretern gebildet. Die Arten innerhalb dieses Monophylums zeigen keine Hinweise auf einen sekundären Verlust von Plastiden[6].
Die Gruppe wird wie folgt unterteilt:[8]
- Heteronematina
- Anisonema
- Dinema
- Entosiphon
- Heteronema
- Lentomonas
- Metanema
- Notosolenus
- Peranema
- Petalomonas
- Ploeotia
- Euglenophyceae
- Rapaza viridis
- Eutreptiales
- Eutreptia
- Eutreptiella
- Euglenea
- Phacaceae
- Discoplastis
- Lepocinclis
- Phacus
- Euglenaceae
- Ascoglena
- Colacium
- Cryptoglena
- Cyclidiopsis
- Euglena
- Euglenaria
- Euglenopsis
- Monomorphina
- Strombomonas
- Trachelomonas
- Phacaceae
- Aphagea
- Astasia
- Distigma
- Distigmopsis
- Menoidium
- Rhabdomonas
Quellen
- William Marande, Julius Lukeš und Gertraud Burger; 2005; Unique Mitochondrial Genome Structure in Diplonemids, the Sister Group of Kinetoplastids; American Society for Microbiology
- Doz. U. Struck; WS 01/02; Vorlesung: Einführung in die Mikropaläontologie; Pal. München; Einführung in die Mikropaläontologie (WS 01/02, Pal. München, Doz. U. Struck) Donnerstags 12:15 – 13:45 (Memento vom 28. September 2007 im Internet Archive)
- Susanne Talke; 2000; Morphologische und molekularbiologische Untersuchungen zur Evolution der Euglenida; Dissertation zur Erlangung des Grades einer Doktorin der Naturwissenschaften (Dr. rer. nat.) der Fakultät für Biologie der Universität Bielefeld
Einzelnachweise
- Huber-Pestalozzi, G. (1955): Das Phytoplankton des Süsswassers: Euglenophyceen, Band 4
- Michajlow, W. (1972): Euglenoidina parasitic in Copepoda. PWN-Polish Scientific Publishers.
- Peter H. Raven, Ray F. Evert, Susan E. Eichhorn: Biologie der Pflanzen, 3. Auflage, 2000, ISBN 3-11-015462-5, S. 376.
- Leedale GF (1967) Euglenoid Flagellates. Prentice-Hall, Inc., Englewood Cliffs, New Jersey.
- Farmer MA (1988) A re-evaluation of the taxonomy of the Euglenophyceae based on ultrastructural characteristics. (Dissertation) Rutgers University, Piscataway, New Jersey
- Busse, I. & Preisfeld, A. 2003. Systematics of primary osmotrophic euglenids: A molecular approach to the phylogeny of Distigma and Astasia (Euglenozoa). Int. J. Syst. Evol. Microbiol. 53(Pt 2):617-24
- Gockel, G. & Hachtel, W. (2000): Complete gene map of the plastid genome of the nonphotosynthetic euglenoid flagellate Astasia longa. Protist 151(4): 347–351.
- Adl, S. M., Simpson, A. G. B., Lane, C. E., Lukeš, J., Bass, D., Bowser, S. S., Brown, M. W., Burki, F., Dunthorn, M., Hampl, V., Heiss, A., Hoppenrath, M., Lara, E., le Gall, L., Lynn, D. H., McManus, H., Mitchell, E. A. D., Mozley-Stanridge, S. E., Parfrey, L. W., Pawlowski, J., Rueckert, S., Shadwick, L., Schoch, C. L., Smirnov, A. and Spiegel, F. W.: The Revised Classification of Eukaryotes. Journal of Eukaryotic Microbiology, 59: 429–514, 2012, The Revised Classification of Eukaryotes PDF Online
- Gommers-Ampt JH, Van Leeuwen F, de Beer AL, Vliegenthart JF, Dizdaroglu M, Kowalak JA, Crain PF, Borst P (1993): Beta-D-glucosyl-hydroxymethyluracil: a novel modified base present in the DNA of the parasitic protozoan T. brucei. Cell 75: S. 1129–1136