Cysteamin
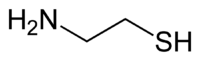
Cysteamin ist eine organisch-chemische Verbindung mit der Konstitutionsformel HSCH2CH2NH2. Es ist der einfachste stabile Vertreter der Stoffklasse der Aminothiole. Aus einer salzsauren wässrigen Lösung kristallisiert das Hydrochlorid mit der Formel C2H7NS · HCl mit dem Schmelzpunkt 70–71 °C aus.[3] Cysteamin ist nicht zu verwechseln mit Cystamin, das sich vom Cystin ableitet, und das Disulfid des Cysteamins repräsentiert.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Cysteamin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C2H7NS | |||||||||||||||||||||
| Kurzbeschreibung |
farbloses kristallines Pulver mit unangenehmem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 77,15 g·mol −1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
zersetzt sich[2] | |||||||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser mit alkalischer Reaktion,[3] leicht löslich in Methanol und Ethanol[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Vorkommen
In der Natur tritt der Stoff als Abbauprodukt durch Decarboxylierung der Aminosäure Cystein auf, weshalb es auch den Trivialnamen Decarboxycystein trägt. Beim Abbau von Coenzym A entsteht ebenfalls Cysteamin.
Gewinnung und Darstellung
Cysteamin kann durch die Reaktion von Aziridin mit Schwefelwasserstoff gewonnen werden.[5]
Struktur
Cysteamin besteht aus einer Ethan-Grundstruktur, welche an den beiden Kohlenstoffatomen mit je einer Thiol- bzw. einer Aminogruppe substituiert ist.
Chemische Eigenschaften
Es wird als Hydrochlorid verwendet, da das freie Thiol leicht zum korrespondierenden Disulfid oxidiert wird. Die Oxidation des Cysteamins zum Disulfid wird durch Erwärmung für einige Stunden bei 80 °C mit Triethylamin in Dimethylformamid unter Luftsauerstoff erleichtert. Zusätzlich kann die Reaktion für einige Minuten unter Ultraschall bei Raumtemperatur beschleunigt werden.[6]
Biosynthese
Bei dem Abbau von Coenzym A entsteht zunächst Pantethein, welches durch das Enzym Pantetheinase (auch Vanin genannt) zu Pantothensäure und Cysteamin umgesetzt werden. Cysteamin, ebenso wie Cystein, können durch die Cysteamin-Dioxygenase zu Hypotaurin umgewandelt und anschließend mithilfe der Hypotaurin-Dehydrogenase zu Taurin oxidiert werden. Anschließend kann man Taurin zu Gallensalze umwandeln und, nachdem die Gallensalze den Darm-Leber-Kreislauf durchlaufen haben, ausgeschieden werden.[7]
Man vermutet, dass weniger als 3 % des entstandenen Cysteamins mithilfe einer Methyltransferase und anschließender Umsetzung durch Cytochrom P450 zu Methanthiol und Acetamid umgewandelt werden. Darauffolgend wird Methanthiol durch eine andere Methyltransferase zu Dimethylsulfid umgewandelt.[8]
Biochemische und pharmazeutische Verwendung
Unter dem Handelsnamen Cystagon (Zulassung im Juni 1997) bzw. Procysbi (retardierte Zubereitung: Cysteamin-Hydrogentartrat, Zulassung im September 2013) wird es zur Behandlung bei Störungen der Cystinexkretion (nephropathische Cystinose und Cystinurie) verwendet.[3] Im menschlichen Körper wird Cysteamin zu den Lysosomen transportiert, wo es mit Cystin unter Spaltung von dessen Disulfidbrücke reagiert und dabei das Disulfid mit Cystein bildet. Dieses ist viel leichter löslich als Cystin und wird daher besser über die Nieren ausgeschieden. Außerdem wird es aufgrund seiner Radikalfänger-Eigenschaft zur Behandlung der Strahlenkrankheit verwendet.[9]
Im menschlichen Organismus ist Cysteamin eine Komponente des Coenzyms A, das weitere Komponenten wie β-Alanin, Pantoinsäure (2,4-Dihydroxy-3,3-dimethylbuttersäure), Diphosphat und das 3′-phosphorylierte Adenosin beinhaltet. Dabei bilden β-Alanin und Pantoinsäure zusammen die Pantothensäure. Betrachtet man diese zusammen mit Cysteamin, spricht man vom Pantethein. Durch die Thiolgruppe (SH-Gruppe) des Cysteamin-Anteils ist das Coenzym A in der Lage, energiereiche Verbindungen einzugehen. Diese Verbindungen geht es mit den Carboxygruppen (–COOH) von Alkan- und Fettsäuren unter Bildung von Thioesterbindungen ein.
Im November 2008 wurde vom biopharmazeutischen Unternehmen Raptor Pharmaceutical (heute Horizon Therapeutics) in Zusammenarbeit mit dem Centre hospitalier universitaire d'Angers in Frankreich angekündigt, dass die Behandlung der Chorea Huntington mithilfe von Cysteamin-Hydrogentartrat genauer untersucht werden soll.[10] Nach einer dreijährigen klinischen Studie wurden im Dezember 2015 die Ergebnisse präsentiert und es konnte nicht bewiesen werden, dass es zu Verbesserungen führte, jedoch bei vereinzelten Patienten zu leichten Verzögerungen der Symptome kam und keine intoleranten Nebenwirkungen hatte.[11] Zur Behandlung der neuronalen Ceroid-Lipofuszinose wird eine Kombinationstherapie mit Cysteamin-Hydrogentartrat und N-Acetylcystein empfohlen.[12] Bei der Behandlung der nichtalkoholischen Steatohepatitis von Kindern mit Cysteamin-Hydrogentartrat werden die Alanin-Aminotransferase- und Aspartat-Aminotransferase-Konzentration gesenkt, sowie das Risiko einer Läppchenentzündung der Leber ebenfalls vermindert.[13]
Einzelnachweise
- Sicherheitsdatenblatt. (PDF; 85.926 Bytes) In: datasheets.scbt.com. Santa Cruz Biotechnology, Inc., S. 4, abgerufen am 9. Dezember 2015.
- Eintrag zu Cysteamine in der Hazardous Substances Data Bank, abgerufen am 9. Dezember 2015 (online auf PubChem).
- Eintrag zu Cysteamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Oktober 2016.
- Datenblatt Cysteamin (PDF) bei Carl Roth, abgerufen am 9. Dezember 2015.
- Reid, E. Emmet: Organic Chemistry of Bivalent Sulfur. (PDF; 17.730 kB) In: Chemical Publishing Company. 1, Nr. 8, 1958, S. 398–399.
- José Luis García Ruano, Alejandro Parra, José Alemán: Efficient synthesis of disulfides by air oxidation of thiols under sonication. In: Green Chemistry. 10, 2008, S. 706, doi:10.1039/B800705E.
- L. Gallego-Villar, Luciana Hannibal, J. Häberle, B. Thöny, T. Ben-Omran, G. K. Nasrallah, Al-N. Dewik, W. D. Kruger, H. J. Blom: Cysteamine revisited: repair of arginine to cysteine mutations. In: Journal of Inherited Metabolic Disease. 40, 2017, S. 555, doi:10.1007/s10545-017-0060-4.
- W A Gahl, F. Tietze, J D Butler, J D Schulman: Cysteamine depletes cystinotic leucocyte granular fractions of cystine by the mechanism of disulphide interchange. In: Biochemical Journal. 228, 1985, S. 545, doi:10.1042/bj2280545.
- B. P. Lukashin, A. N. Grebeniuk: Comparative study of the radiation-protective effectiveness of low doses of cysteamine, heparin, and naphtizine in experiments on mice. In: Radiats Biol Radioecol. 2001. PMID 11458646.
- Raptor Pharmaceutical Completes DR Cysteamine Phase 2b Clinical Trial in Cystinosis. In: FierceBiotech. 24. November 2009, abgerufen am 7. Juli 2019 (englisch).
- Looking Past the Spin: Results from a Clinical Trial of Cysteamine. In: eurohuntington. 11. Januar 2016, abgerufen am 7. Juli 2019 (englisch).
- Sondra W Levin, Eva H Baker, Wadih M Zein, Zhongjian Zhang, Zenaide M N Quezado, Ning Miao, Andrea Gropman, Kurt J Griffin, Simona Bianconi, Goutam Chandra, Omar I Khan, Rafael C Caruso, Aiyi Liu, Anil B Mukherjee: Oral cysteamine bitartrate and N-acetylcysteine for patients with infantile neuronal ceroid lipofuscinosis: a pilot study. In: The Lancet Neurology. 13, 2014, S. 777, doi:10.1016/S1474-4422(14)70142-5.
- Jeffrey B. Schwimmer, Joel E. Lavine: In Children With Nonalcoholic Fatty Liver Disease, Cysteamine Bitartrate Delayed Release Improves Liver Enzymes but Does Not Reduce Disease Activity Scores. In: Gastroenterology. 151, 2016, S. 1141, doi:10.1053/j.gastro.2016.08.027.
