Lapatinib
Lapatinib ist ein dualer Tyrosinkinase-Inhibitor, der als Arzneistoff zur Behandlung bösartiger Tumoren verwendet wird.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
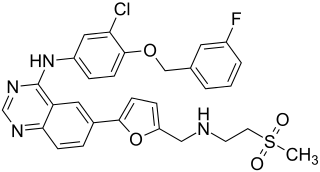 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Lapatinib | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C29H26ClFN4O4S | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
L01XE07 | |||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Wirkmechanismus | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 581,06 g·mol−1 | |||||||||||||||
| Schmelzpunkt |
144–146 °C[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Lapatinib wurde von der Firma GlaxoSmithKline entwickelt und wird unter dem Handelsnamen Tykerb® (USA) bzw. Tyverb® (Europa) vermarktet. Es ist zur Behandlung von Patientinnen mit HER2/neu positivem Brustkrebs (Mammakarzinom) geeignet, wenn die Krebszellen vermehrt die Rezeptoren Erb1 (EGFR) und Erb2 (HER2/neu) auf ihrer Oberfläche ausbilden (exprimieren), was etwa bei 25 % der Brustkrebspatientinnen der Fall ist.
Wirkmechanismus
Das kleine Molekül dringt in die Krebszelle ein und blockiert hier die Tyrosinkinasedomäne der Rezeptoren EGFR und HER2. Wachstumsfaktoren können sich dann zwar noch an die auf der Oberfläche der Zelle liegenden Bindestellen der Rezeptoren anlagern, aber die Signale, die den Zellteilungsprozess auslösen, werden nicht mehr weitergeleitet.
Wegen der geringen Molekülgröße kann Lapatinib im Gegensatz zu anderen Brustkrebs-Medikamenten die Blut-Hirn-Schranke passieren und könnte daher auch bei Patientinnen mit Hirnmetastasen wirken[2] – bisher konnte die Wirksamkeit jedoch nicht zweifelsfrei belegt werden.
Aktuelle Studienlage
Erste klinische Studien zeigten eine Tumorwirksamkeit,[3] insbesondere bei fortgeschrittenem und metastasiertem Brustkrebs.[4] Es fand sich eine Ansprechrate von 35 %. In der Studie, die der Zulassung zu Grunde liegt,[5] verlängerte eine Therapie mit Lapatinib signifikant die Zeit bis zum Fortschreiten der Erkrankung. Lapatinib wird aktuell in mehreren klinischen Studien weiter untersucht, so zum Beispiel für die neoadjuvante und adjuvante Therapie sowie für den Einsatz beim inflammatorischen Mammakarzinom.
Vergleichsdaten aus klinischen Studien haben gezeigt, dass Kombinationstherapien, die Lapatinib enthalten, in bestimmten Behandlungssituationen weniger wirksam sind als solche, die Trastuzumab (Herceptin®) enthalten.[6]
Anwendung
In der Schweiz ist Lapatinib seit Mai 2007 zur Kombinationsbehandlung mit Capecitabin bei Patientinnen mit fortgeschrittenem oder metastasiertem Brustkrebs bei Überexpression von HER2 mit Rezidiv nach oder Nichtansprechen auf Trastuzumab zugelassen. Seit 2008 ist Lapatinib in der EU zur Kombinationsbehandlung mit Capecitabin bei Patientinnen mit fortgeschrittenem oder metastasiertem HER2-positivem Brustkrebs zugelassen, die bereits mit Anthracyclinen, Taxanen und in der metastasierten Situation mit Trastuzumab vorbehandelt wurden. 2010 wurde die Zulassung erweitert: Lapatinib ist seitdem auch in Kombination mit einem Aromatasehemmer zur Behandlung postmenopausaler Patientinnen mit Hormonrezeptor- und HER2-positivem metastasiertem Brustkrebs zugelassen (s. akt. Studienlage).
Ein Vorteil ist, dass das Medikament in Tablettenform eingenommen werden kann. Eine Infusionstherapie wie bei Trastuzumab ist nicht erforderlich.
Unerwünschte Nebenwirkungen
Als Nebenwirkungen traten bisher Hautausschlag, Übelkeit und Durchfall auf, schwere Nebenwirkungen wurden nicht beobachtet. Die kardiale Verträglichkeit war gut. Die durch den Hersteller überprüften Sicherheitsdaten ergaben aber, dass während der Therapie mit Lapatinib hepatotoxische Reaktionen auftreten können. In erster Linie kam es zu erhöhten Werten der Transaminasen, selten war die Hepatotoxizität schwerwiegend oder sogar letal. Per Roten-Hand-Brief vom 27. März 2008 informierte GlaxoSmithKline die Ärzte über die Nebenwirkung, und die Fachinformation wurde entsprechend angepasst. Es wird insbesondere auf die regelmäßige Untersuchung der Leberfunktion (Bilirubin, Transaminasen, alkalische Phosphatase) hingewiesen.[7]
Weblinks
- Studien zu Lapatinib
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Tyverb
Einzelnachweise
- Eintrag zu Lapatinib bei Toronto Research Chemicals, abgerufen am 1. Dezember 2018 (PDF).
- HER2-positiver Brustkrebs: „Kleines Molekül“ Lapatinib hilft auch bei Hirnmetastasen. Dtsch Arztebl 2007; 104(30): A-2146 / B-1900 / C-1836.
- Burris, H.A. (2004): Dual kinase inhibition in the treatment of breast cancer: initial experience with the EGFR/ErbB-2 inhibitor lapatinib. In: Oncologist. Bd. 9, S. 10–15, PMID 15163842.
- Nelson, M.H. & Dolder, C.R. (2006): Lapatinib: a novel dual tyrosine kinase inhibitor with activity in solid tumors. In: Ann Pharmacother. Bd. 40, S. 261–269, PMID 16418322.
- Cameron D et al.: A phase III randomized comparison of lapatinib plus capecitabine versus capecitabine alone in women with advanced breast cancer that has progressed on trastuzumab: updated efficacy and biomarker analyses. In: Breast Cancer Res Treat. 2008 Dec;112(3):533–543, PMID 18188694.
- Wichtige Informationen für Fachkreise zu Tyverb® (Lapatinib) (PDF; 803 kB), Meldung von GSK vom 10. Dezember 2012.
- Tyverb Lapatinib und hepatotoxische Reaktionen (in erster Linie Erhöhung der Transaminasen) (Memento vom 7. April 2013 im Webarchiv archive.today), Rote-Hand-Brief von GlaxoSmithKline vom 27. März 2008.