Anthracycline
Anthracycline oder Anthrazykline sind eine aus Streptomyces-Arten isolierte Stoffgruppe mit antibiotischen und antineoplastischen Wirkungen.
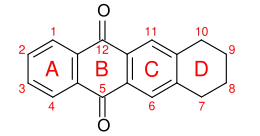
Chemisch handelt es sich um Glycoside mit einem Cyclohexan-anellierten Anthrachinon-Grundgerüst, dem 7,8,9,10-Tetrahydrotetracen-5,12-dion, als Aglycon. Neben weiteren Substituenten besitzen die Anthracycline mehrere Hydroxygruppen. Die glycosidische Bindung mit dem Kohlenhydrat befindet sich in vielen Fällen am D-Ring des Aglycons.[1]
Sie sind verwandt mit den Angucyclinen, diese unterscheiden sich durch den im Winkel (lat.: angulus) am Anthrachinon anellierten Cyclohexan-Ring.
Anthracycline werden als Zytostatika in der Chemotherapie gegen verschiedene Krebsarten eingesetzt. Zu ihnen gehören z. B. Epirubicin, Idarubicin, Doxorubicin, Daunorubicin, Pirarubicin, Zorubicin, Aclarubicin und Caminomycin.[2]
Geschichte
Das erste Anthracyclin, Daunorubicin, wurde erstmals 1963 gleichzeitig in Italien (durch Farmitalia)[3] und Frankreich (durch Rhône-Poulenc)[4] aus Streptomyces peucetius isoliert.[5][6] Eine zytotoxische Wirkung gegen Leukämiezellen wurde identifiziert.[6] Doxorubicin wurde 1969 durch Farmitalia aus dem mutierten Stamm Streptomyces peucetius caesius isoliert und besaß eine zytotoxische Wirkung auch gegen solide Tumoren.[7][6]
Biologische Bedeutung
Anthracycline wirken unter anderem, indem sie an das Enzym Topoisomerase IIα binden.[8] Topoisomerase IIα ist ein Schlüsselenzym der Zellteilung. Zudem interkalieren Anthracycline in die DNA und verhindern dadurch eine weitere Nukleinsäuresynthese. Ein weiterer Wirkmechanismus ist, dass durch Biotransformation freie Radikale entstehen, die Doppelstrangbrüche der DNA erzeugen können und zu DNA-Addukten führen. Auch lösen sich Histone von der DNA.[9] Weiterhin können Anthracycline zu einer mangelnden Funktion der Mitochondrien führen.[10] Ferner wird durch Bindung der Anthracycline an die Zellmembran deren Permeabilität und Fluidität erhöht, was zu vermehrtem Absterben der betroffenen Zelle führt.
Anthracycline greifen in grundlegende biochemische Reaktionsabläufe ein und beeinträchtigen Stoffwechselprozesse außer in tierischen Zellen auch bei Bakterien. Daraus resultiert eine antibiotische Wirkung. Daunorubicin etwa besitzt eine schwache Aktivität gegen gramnegative Bakterien, die nicht therapeutisch genutzt wird.[11]
Kardiotoxizität
Wegen des schnellen Wachstums von Krebszellen werden diese durch Anthracycline stärker gestört als gesunde Zellen. Allerdings werden auch gesunde Körperzellen angegriffen, was zu schweren, teilweise irreversiblen Nebenwirkungen wie Störungen des Knochenmarks und vor allem des Herzens führen kann. Es besteht die Gefahr der Kardiomyopathie mit irreversibler Herzinsuffizienz.[12] Diese unerwünschte Wirkung erfolgt durch Hemmung der Topoisomerase IIβ, welche die einzige Topoisomerase in Herzmuskelzellen ist, und durch die Bildung von Radikalen in Herzmuskelzellen.[13][14] Zur Minderung der Kardiotoxizität wurde der Eisen-Chelator Dexrazoxan entwickelt.[15][16] Weiterhin mindern liposomale Arzneimittelformulierungen die Nebenwirkung.[17] Eine geringere Infusionsrate führt zu niedrigeren Spitzenkonzentrationen in der linken Herzkammer.[18]
Ein weiteres Problem in der Therapie mit Anthracylinen sind Resistenzen, die ein Tumor entwickeln kann.[19] Ansätze zur strukturellen Veränderung der Anthracycline zur besseren Überwindung der Blut-Hirn-Schranke werden untersucht.[2][19]
Literatur
- Anthracycline Chemistry and Biology I. Biological Occurence and Biosynthesis, Synthesis and Chemistry. In: Karsten Krohn (Hrsg.): Topics in Current Chemistry. Nr. 282. Springer-Verlag, Berlin, Heidelberg 2008, ISBN 978-3-540-75814-3 (eingeschränkte Vorschau in der Google-Buchsuche).
- Anthracycline Chemistry and Biology II. Mode of Action, Clinical Aspects and New Drugs. In: Karsten Krohn (Hrsg.): Topics in Current Chemistry. Nr. 283. Springer-Verlag, Berlin, Heidelberg 2008, ISBN 978-3-540-75812-9 (eingeschränkte Vorschau in der Google-Buchsuche).
- Anke Kruger, Leszek Wojnowski: Kardiotoxizität von Anthrazyklinen – ein ungelöstes Problem, Deutsches Ärzteblatt, Jg. 103, Heft 37, 15. September 2006.
Einzelnachweise
- Hartmut Laatsch, Serge Fotso: Naturally Occurring Anthracyclines. In: Karsten Krohn (Hrsg.): Anthracycline Chemistry and Biology. Nr. I. Springer-Verlag, Berlin, Heidelberg 2008, ISBN 978-3-540-75814-3, S. 4 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- Q. Ashton Acton: Anthracyclines—Advances in Research and Application: 2013 Edition. Scholarly Editions, 2013, ISBN 978-1-4816-7278-8, S. 23.
- Grein A, et al. Descrizione e classificazione di un attinomicete (Streptomyces peucetius sp. nova) produttore di una sostanza ad attivita antitumorale. Giorn. Microbiol. 11, 1963, S. 109–118.
- M. Dubost, P. Ganter, R. Maral, L. Ninet, S. Pinnert, J. Preudhomme, G. H. Werner: [A NEW ANTIBIOTIC WITH CYTOSTATIC PROPERTIES: RUBIDOMYCIN.] In: C. R. Hebd. Seances Acad. Sci., 257, 1963, S. 1813–1815; Digitalisat auf Gallica; PMID 14090569.
- R. B. Weiss: The anthracyclines: will we ever find a better doxorubicin? In: Seminars in Oncology. Band 19, Nummer 6, Dezember 1992, S. 670–686, PMID 1462166.
- Jan H. M. Schellens: Cancer Clinical Pharmacology. OUP Oxford, 2005, ISBN 978-0-19-262966-1, S. 117–119.
- F. Arcamone, G. Cassinelli, G. Fantini, A. Grein, P. Orezzi, C. Pol, C. Spalla: Adriamycin, 14-hydroxydaunomycin, a new antitumor antibiotic from S. peucetius var. caesius. In: Biotechnology and Bioengineering. Band 11, Nummer 6, November 1969, S. 1101–1110, doi:10.1002/bit.260110607, PMID 5365804.
- Piccart-Gebhart, M. J. (2006): Anthracyclines and the tailoring of treatment for early breast cancer. In: N. Engl. J. Med. Bd. 354, S. 2177–2179; PMID 16707755.
- B. Pang, X. Qiao, L. Janssen, A. Velds, T. Groothuis, R. Kerkhoven, M. Nieuwland, H. Ovaa, S. Rottenberg, O. van Tellingen, J. Janssen, P. Huijgens, W. Zwart, J. Neefjes: Drug-induced histone eviction from open chromatin contributes to the chemotherapeutic effects of doxorubicin. In: Nature Communications. Band 4, 2013, S. 1908, doi:10.1038/ncomms2921, PMID 23715267, PMC 3674280 (freier Volltext).
- A. Mordente, E. Meucci, A. Silvestrini, G. E. Martorana, B. Giardina: Anthracyclines and mitochondria. In: Advances in Experimental Medicine and Biology. Band 942, 2012, S. 385–419, doi:10.1007/978-94-007-2869-1_18, PMID 22399433.
- T. Dingermann, Karl Hiller, G. Schneider, I. Zündorf: Schneider Arzneidrogen. 5. Auflage. Elsevier, 2004. S. 584 ff.
- T. K. Sethi, B. Basdag, N. Bhatia, J. Moslehi, N. M. Reddy: Beyond Anthracyclines: Preemptive Management of Cardiovascular Toxicity in the Era of Targeted Agents for Hematologic Malignancies. In: Current Hematologic Malignancy Reports. Band 12, Nummer 3, Juni 2017, S. 257–267, doi:10.1007/s11899-017-0369-y, PMID 28233150.
- S. Zhang, X. Liu, T. Bawa-Khalfe, L. S. Lu, Y. L. Lyu, L. F. Liu, E. T. Yeh: Identification of the molecular basis of doxorubicin-induced cardiotoxicity. In: Nature Medicine. Band 18, Nummer 11, November 2012, S. 1639–1642, doi:10.1038/nm.2919, PMID 23104132.
- A. Mordente, E. Meucci, G. E. Martorana, D. Tavian, A. Silvestrini: Topoisomerases and Anthracyclines: Recent Advances and Perspectives in Anticancer Therapy and Prevention of Cardiotoxicity. In: Current Medicinal Chemistry. Band 24, Nummer 15, 2017, S. 1607–1626, doi:10.2174/0929867323666161214120355, PMID 27978799.
- D. W. Edwardson, R. Narendrula, S. Chewchuk, K. Mispel-Beyer, J. P. Mapletoft, A. M. Parissenti: Role of Drug Metabolism in the Cytotoxicity and Clinical Efficacy of Anthracyclines. In: Current Drug Metabolism. Band 16, Nummer 6, 2015, S. 412–426, PMID 26321196, PMC 5398089 (freier Volltext).
- E. C. van Dalen, H. N. Caron, H. O. Dickinson, L. C. Kremer: Cardioprotective interventions for cancer patients receiving anthracyclines. In: The Cochrane Database of Systematic Reviews. Nummer 6, Juni 2011, S. CD003917, doi:10.1002/14651858.CD003917.pub4, PMID 21678342.
- E. A. Forssen, Z. A. Tökes: In vitro and in vivo studies with adriamycin liposomes. In: Biochemical and Biophysical Research Communications. Band 91, Nummer 4, Dezember 1979, S. 1295–1301, PMID 526304.
- G. Minotti, P. Menna, E. Salvatorelli, G. Cairo, L. Gianni: Anthracyclines: molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity. In: Pharmacological Reviews. Band 56, Nummer 2, Juni 2004, S. 185–229, doi:10.1124/pr.56.2.6, PMID 15169927.
- M. da Ros, A. L. Iorio, M. Lucchesi, A. Stival, M. de Martino, I. Sardi: The Use of Anthracyclines for Therapy of CNS Tumors. In: Anti-Cancer Agents in Medicinal Chemistry. Band 15, Nummer 6, 2015, S. 721–727, PMID 25846760, PMC 4997942 (freier Volltext).