Eribulin
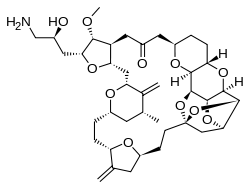
Eribulin (Handelsname Halaven; Hersteller Eisai) ist ein nicht Taxan-basiertes Zytostatikum, das in Monotherapie für die Behandlung von Patienten mit lokal fortgeschrittenem oder metastasiertem Brustkrebs eingesetzt wird. Eribulin unterbindet durch Inhibition der Mikrotubuli-Dynamik die Replikation von Tumorzellen, ohne dabei jedoch eine Depolymerisation bestehender Tubuli zu bewirken. Eribulin ist ein strukturell vereinfachtes synthetisches Analogon des natürlicherweise im Meeresschwamm Halichondria okadai vorkommenden Halichondrin B.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Eribulin | ||||||||||||||||||
| Andere Namen |
2-(3-Amino-2-hydroxypropyl)hexacosahydro-3-methoxy-26-methyl-20,27-bis(methylen)-11,15-18,21-24,28-triepoxy-7,9-ethano-12,15-methano-9H,15H-furo[3,2-i]furo[2′,3′-5,6]pyrano[4,3-b](1,4)dioxacyclopentacosin-5-(4H)-on | ||||||||||||||||||
| Summenformel | C40H59NO11 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
L01XX41 | ||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 729.90 g·mol−1 | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte und Entwicklung
Die Entwicklung von Eribulin verlief in mehreren Schritten. Am Anfang stand die Isolierung von Halichondrin B aus dem pazifischen Meeresschwamm Halichondria okadai im Jahr 1986 und seine chemische Synthese durch Harvard-Wissenschaftler sechs Jahre später. Halichondrin B besitzt eine deutliche antitumorale Aktivität, ist aber strukturell sehr komplex. Mit Eribulin wurde 1997 durch Eisai ein synthetisches Analogon dieses Naturprodukts entwickelt, das eine einfachere, aber immer noch relativ komplexe Molekülstruktur besitzt.[2]
Therapeutischer Einsatz
Eine Eribulin-Monotherapie ist indiziert für die Behandlung von Patienten mit lokal fortgeschrittenem oder metastasiertem Brustkrebs, bei denen nach einer vorangegangenen Chemotherapie zur Behandlung einer fortgeschrittenen Brustkrebserkrankung eine weitere Progression (Verschlimmerung) eingetreten ist. Die Vortherapien sollen ein Anthracyclin und ein Taxan enthalten haben, es sei denn, diese Behandlungen waren ungeeignet für den Patienten. Eribulin ist die erste monotherapeutisch angewendete Behandlung, für die bei Patientinnen mit fortgeschrittenem Brustkrebs nach erfolgter Taxan- und Anthracyclin-Behandlung ein signifikanter Nutzen in Bezug auf das Gesamtüberleben nachgewiesen werden konnte.[3][4]
Zulassungsstatus
Eribulin wurde im November 2010 in den USA von der Food and Drug Administration (FDA) in Monotherapie für die Behandlung von Patienten mit lokal fortgeschrittenem oder metastasiertem Brustkrebs zugelassen.[5][6]
Im März 2011 hat die Europäische Kommission Eribulin in allen 27 EU-Mitgliedstaaten in der o. a. Indikation zugelassen.[7] Die kanadische Zulassungsbehörde Health Canada hat im Dezember 2011 Eribulin für Kanada in der o.a. Indikation zugelassen.[8]
Frühe Nutzenbewertung
Seit 2011 müssen sich neu zugelassene Medikamente mit neuen Wirkstoffen aufgrund § 35a SGB V (AMNOG) einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterziehen, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Dies galt auch für Eribulin. Zunächst hat das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) eine Bewertung abgegeben. Eine positive Beschlussfassung („Anhaltspunkt für einen geringen Zusatznutzen“) durch den G-BA erfolgte im April 2012.[9][10]
Wirkmechanismus von Eribulin
Bei Eribulin handelt es sich um einen Inhibitor der Mikrotubuli-Dynamik. Die Substanz inhibiert die Polymerisation von Tubulin-Molekülen zu Mikrotubuli und kapselt Tubulin in nicht produktive Aggregate ab. Die fehlende Ausbildung des Spindelapparates bewirkt eine Blockade der Mitose und induziert eine Apoptose. Eribulin unterscheidet sich von den bekannten Mikrotubuli-Inhibitoren (Taxane, Vinca-Alkaloide) durch die Bindungsstelle an den Mikrotubuli und den fehlenden Effekt auf die Mikrotubuli-Verkürzung. Diese Eigenschaften werden zum einen als Grund für die geringere Toxizität von Eribulin im Vergleich zu Taxanen und Vinca-Alkaloiden diskutiert. Zum anderen erklärt sich hierdurch auch die Wirksamkeit von Eribulin in Taxan resistenten Tumorzelllinien mit ss-Tubulinmutationen.[11]
Wirksamkeit
Eribulin zeigte bei mit Anthracyclin und Taxan vorbehandelten Patienten mit lokal fortgeschrittenem oder metastasiertem Brustkrebs einen signifikanten Überlebensvorteil als Monotherapie gegenüber einer Therapie nach Wahl durch den Prüfarzt (Treatment of Physician’s Choice; TPC). Dieser Vorteil wurde erreicht, ohne dass vermehrt Behandlungsabbrüche aufgrund von unerwünschten Ereignissen festgestellt wurden. Die beobachteten Toxizitäten und unerwünschten Wirkungen entsprechen denen eines Chemotherapeutikums, womit in den Studien ein kalkulierbares und überschaubares Verträglichkeitsprofil etabliert werden konnte. Die Kurzinfusion über 2–5 Minuten trägt zur Zufriedenheit der Patientinnen mit der Therapie bei. Die vorliegenden Ergebnisse der EMBRACE Studie und das verbesserte Gesamtüberleben lassen Eribulin als Substanz erscheinen, die sich als Standardoption bei stark vortherapierten Patientinnen mit lokal fortgeschrittenem oder metastasiertem Mammakarzinom etablieren könnte.[12]
Überlebensvorteil bei metastasiertem Brustkrebs
Bei intensiv vorbehandelten Frauen mit fortgeschrittenem Brustkrebs hat Eribulin vielversprechende Ergebnisse erzielt.
Eribulin wurde in einer Phase-III-Studie EMBRACE (Eisai Metastatic Breast Cancer Study Assessing Physician’s Choice vs. Eribulin) mit verschiedenen, von den Prüfzentren bestimmten Monotherapien (Treatment of Physician’s Choice=TPC) verglichen. Die von der europäischen und der US-amerikanischen Aufsichtsbehörde geforderte aktualisierte Analyse von 589 Ereignissen ergab ein medianes Gesamtüberleben von 13,2 bzw. 10,5 Monaten (HR 0,81; nominal p=0,014). Das entspricht einer Verlängerung des Gesamtüberlebens um 2,7 Monate. Damit konnte zum ersten Mal ein signifikanter Überlebensvorteil für eine Einzelsubstanz bei stark vortherapierten Patientinnen belegt werden.[12][13][14]
Handelsnamen
- Monopräparat: Halaven
Weblinks
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Eribulin
Einzelnachweise
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von [No public or meaningful name is available] im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 5. Februar 2020.
- H. Ledford: Complex synthesis yields breast-cancer therapy. In: Nature, 2010; 468, S. 608-609; doi:10.1038/468608a.
- Fachinformation Halaven. (PDF; 542 kB) Stand März 2011.
- Europäischer öffentlicher Beurteilungsbericht (EPAR). (PDF; 65 kB) European Medicines Agency (EMA) (deutsch).
- FDA Pressemeldung
- Eribulin (Halaven) erhält Zulassung der europäischen Kommission für fortgeschrittenen Brustkrebs. In: Journal Onkologie, 2011.
- Summary of the European public assessment report (EPAR) for Halaven European Medicines Agency (EMA) (englisch).
- Eisai announces Canadian approval of its anticancer agent HALAVEN™. Pressemeldung Eisai, 15. Dezember 2011.
- Informationsarchiv – Frühe Nutzenbewertung (§ 35a SGB V). WebSite des Gemeinsamen Bundesausschuss (G-BA); abgerufen am 30. November 2012.
- Beschlüsse über die Nutzenbewertung von Eribulin (PDF; 392 kB), Beschlusstext des G-BA über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII, veröffentlicht unter BAnz AT 15.06.2012 B3.
- Jordan et al.: How Do Microtubule-Targeted Drugs Work? An Overview, Current Cancer Drug Targets 2007 (7): 730-742 doi:10.2174/156800907783220417.
- Javier Cortes, Joyce O'Shaughnessy u. a.: Eribulin monotherapy versus treatment of physician’s choice in patients with metastatic breast cancer (EMBRACE): a phase 3 open-label randomised study. In: The Lancet, 377, 2011, S. 914, doi:10.1016/S0140-6736(11)60070-6.
- Twelves et al., Updated Survival Analysis of a Phase III Study (EMBRACE) of Eribulin Mesylate vs Treatment of Physician’s Choice in Subjects with Locally Recurrent or Metastatic Breast Cancer Previously Treated with an Anthracycline and a Taxane. 33rd Annual San Antonio Breast Cancer Symposium, San Antonio, TX, December 8-12, 2010, P6-14-08.
- A. Schreiberhuber: Intensiv vorbehandeltes Mammakarzinom: Eribulin – signifikanter Überlebensvorteil bestätigt. In: Hämatologie & Onkologie, 2011.