Sorafenib
Sorafenib (Handelsname: Nexavar®, Hersteller: Bayer AG) ist ein Proteinkinaseinhibitor aus der Gruppe der Multi-Kinase-Inhibitoren. Er wird in Form von Tabletten angewendet und wirkt, indem es das Wachstum der Krebszellen verlangsamt und die Blutversorgung, die die Krebszellen wachsen lässt, unterbindet.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
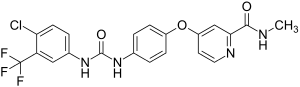 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Sorafenib | |||||||||||||||||||||
| Andere Namen |
4-{4-[3-(4-Chlor-3-trifluormethylphenyl)ureido]phenoxy}pyridin-2-carbonsäuremethylamid (IUPAC) | |||||||||||||||||||||
| Summenformel | C21H16ClF3N4O3 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01XE05 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 464,83 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Anwendungsgebiete und Zulassung
Sorafenib zählt zu den Orphan-Arzneimitteln und ist seit 2006 für einige wenige Indikationen in der EU zugelassen. Diese waren zunächst nur die Behandlung des fortgeschrittenen Nierenkrebses, wenn eine Standardtherapie versagt hat oder ungeeignet ist, und die Behandlung von nicht mehr resezierbarem Leberzellkarzinom (hepatozelluläres Karzinom, HCC). Seit Juni 2014 ist Sorafenib in der EU zusätzlich zur Behandlung metastasierter differenzierter Schilddrüsenkarzinome, die nicht mehr auf eine Radiojodtherapie ansprechen, zugelassen.
Eine Phase-III-Studie zur Erstlinienbehandlung von fortgeschrittenem Hautkrebs war nicht erfolgreich und wurde vorzeitig abgebrochen.[2] Ebenso hat die klinische Phase-III-Studie (Indikation fortgeschrittener Lungenkrebs) den primären Endpunkt – eine Verlängerung des Gesamtüberlebens – nicht erreicht.[3]
Pharmakologie
Als Multi-Kinase-Inhibitor hat Sorafenib mehrere Angriffspunkte:
- Es inhibiert die Raf-Kinase und blockiert somit die Raf-Signalkaskade. Es kommt zu einer verminderten Zellteilung und Proliferation.
- Es inhibiert mehrere Tyrosinkinasen; unter anderem die des VEGF-Signalweges. Es kommt zu einer Blockade der Signalkaskaden und zu einer reduzierten Tumor-Angiogenese.
Nebenwirkungen
Die häufigsten Nebenwirkungen sind Durchfall, Hautausschlag, Haarausfall, Hand-Fuß-Syndrom, verminderte Anzahl von Lymphozyten (Lymphopenie), Blutungen (Hämorrhagie), Bluthochdruck (arterielle Hypertonie), Übelkeit, Erbrechen, Hautrötung, Juckreiz, Müdigkeit (Erschöpfung), Schmerzen sowie erhöhte Amylase- und Lipasewerte.
Zwangslizenz
Das indische Patentamt hat dem Generikahersteller Natco Pharma eine Zwangslizenz zur Produktion von Sorafenib Tosylate für die nächsten acht Jahre zugesprochen – gegen die Zahlung einer Lizenzgebühr in Höhe von sechs Prozent der Verkaufserlöse.[4][5] Mit ein Auslöser für diese Entscheidung ist, dass Bayer die monatlichen Kosten für dieses Medikament mit annähernd 5.000 Euro beziffert. Mit diesem Patentübertrag kann der Generikahersteller die Kosten auf 175 US-Dollar senken, davon sind sechs Prozent an Bayer abzuführen. Dieses Urteil ist weltweit das erste, das einen Hersteller zwingt, seine Preise entweder selbst zu senken oder aber die Herstellung einem anderen Unternehmen zu überlassen. Bayer hat jedoch Widerspruch gegen die Zwangslizenzierung eingelegt.[6]
Zwangslizenzen sind im internationalen Handelsrecht verankert und werden in der Doha Declaration als zulässige Ausnahme zum TRIPS-Abkommen aufgelistet. Sie ermöglichen Staaten, bestehende Patente teilweise zu umgehen, um die öffentliche Gesundheit zu schützen – etwa wenn durch zu hohe Preise der Zugang von Patienten zu Medikamenten beeinträchtigt wird.
Literatur
Übersichtsartikel zur Pharmakologie
- D. Strumberg: Preclinical and clinical development of the oral multikinase inhibitor sorafenib in cancer treatment. In: Drugs Today. 41(12), 2005 Dec, S. 773–784. PMID 16474853.
- D. A. Murphy, S. Makonnen, W. Lassoued, M. D. Feldman, C. Carter, W. M. Lee: Inhibition of tumor endothelial ERK activation, angiogenesis, and tumor growth by sorafenib (BAY43-9006). In: Am J Pathol. 169(5), 2006 Nov, S. 1875–1885. PMID 17071608, PMC 1780219 (freier Volltext).
Übersichtsartikel zur Synthese und Analytik
- S. Afify, U. R. Rapp, P. Högger: Validation of a liquid chromatography assay for the quantification of the Raf kinase inhibitor BAY 43-9006 in small volumes of mouse serum. In: J Chromatogr B Analyt Technol Biomed Life Sci. 809(1), 2004 Sep 25, S. 99–103. PMID 15282098.
- D. Bankston, J. Dumas, R. Natero, B. Riedl, K. K. Monahan, R. Silbey: A scaleable synthesisof BAY 43-9006: apotent Raf kinase inhibitor for the treatment of cancer. In: Organic Process Research & Development. 6 (6), 2002, S. 777–781.
Weblinks
- Europäischer öffentlicher Beurteilungsbericht (EPAR) zu Nexavar (Memento vom 22. August 2006 im Internet Archive) der EMEA
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Melanom: Studienabbruch wegen Wirkungslosigkeit von Sorafenib. (Memento vom 12. September 2013 im Internet Archive) In: Deutsches Ärzteblatt. 5. Dezember 2006.
- Nexavar® versagt bei Lungenkrebs. In: Deutsche Apotheker Zeitung. 22. Mai 2012.
- Erste Zwangslizenz für ein Medikament in Indien. auf: aerzte-ohne-grenzen.at, 12. März 2012.
- Urteil des indischen Patentamts (PDF; 2,2 MB) (Memento vom 21. März 2012 im Internet Archive)
- Bayer kämpft um Nexavar®-Patent. In: Deutsche Apotheker Zeitung. 7. Mai 2012.