Sauerstoffkorrosion
Als Sauerstoffkorrosion bezeichnet man einen Korrosionsvorgang, bei dem ein Metall in Gegenwart von Wasser (Luftfeuchtigkeit) durch Sauerstoff oxidiert wird. Bei dieser Redoxreaktion ist Sauerstoff das Oxidationsmittel, ebenso wie bei einer Verbrennung in einer Sauerstoffatmosphäre. Der Vorgang läuft jedoch unter Beteiligung von Wasser oder einer Elektrolytlösung ohne Erwärmung und Flammenerscheinungen ab.


Beispiele
Beispiele für solche Korrosionsvorgänge sind die Bildung von Rost an Eisenwerkstoffen und die Bildung von Patina auf Kupfer. Die Kupferpatinabildung ist jedoch, weil auch Kohlendioxid und Wasser bzw. Kohlensäure beteiligt sind, sowohl der Säurekorrosion wie auch der Sauerstoffkorrosion zuzuordnen.
Voraussetzungen
Die chemische Reaktion des metallischen Werkstoffes erfolgt unter Einwirkung bzw. Verbrauch von Sauerstoff, d. h. der Sauerstoff wirkt als Oxidationsmittel. Dieser Vorgang läuft vornehmlich in alkalischen und neutralen Lösungen ab.
Voraussetzung für eine Sauerstoff-Korrosion sind:
Ablauf
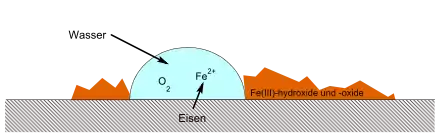
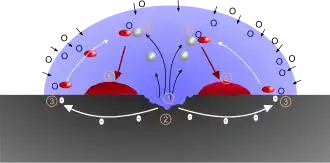
Die in der Elektrolytlösung gelösten Sauerstoffmoleküle reagieren mit Wasser zu Hydroxid-Ionen, welche mit dem Metall Oxide und Hydroxide bilden können. Dieser Vorgang wird am Beispiel der Rostbildung im Artikel Rost erläutert.
Allgemein lässt sich der Verlauf der Sauerstoffkorrosion wie jede Redoxreaktion in die Teilschritte Oxidation (Elektronenabgabe) und Reduktion (Elektronenaufnahme) aufteilen.
- Die Reduktion des Sauerstoffs kann mit folgendem Reaktionsschema beschrieben werden:
- Die Oxidation des Metalls erfolgt unter Abgabe von x Elektronen zum Metall-x-Kation, wobei x der chemischen Wertigkeit (Ionenladung, Oxidationszahl) des Metalles entspricht.
Für ein einwertiges Metall ergäbe sich als Gesamtreaktion somit:
Beim Korrosionsvorgang kann sich ein kurzgeschlossenes galvanisches Element bilden. Dieses besteht aus zwei Metallen oder Metall-Stücken (Lokalelemente) mit unterschiedlichem Elektrodenpotential (Kathode und Anode) und einer Elektrolytlösung.
Literatur
- Gustav Peter, René Muntwyler, Marc Ladner: Baustofflehre. (= Bau und Energie. Band 3). 2., durchges. und aktualisierte Auflage. vdf Hochschulverlag, 2005, ISBN 3-7281-3005-2.
- Karl-Helmut Tostmann: Korrosion. Ursachen und Vermeidung. Wiley-VCH Verlag, Weinheim 2001, ISBN 3-527-30203-4.
Einzelnachweise
- Das große Tafelwerk. 2002, ISBN 3-464-57146-7, S. 135.
Weblinks
- Korrosionsschäden durch Sauerstoff im Heizungswasser – Sauerstoffkorrosion – (abgerufen am 7. September 2018)
- Rost und Rostschutz (abgerufen am 7. September 2018)
- Bauchemische Grundlagen Elektrochemie Chemie der Metalle (abgerufen am 7. September 2018)
- Korrosion an metallischen Werkstoffen (abgerufen am 7. September 2018)
- Korrosion und Korrosionsschutz (abgerufen am 7. September 2018)