3-Amino-2-azepanon
3-Amino-2-azepanon (DL-Aminocaprolactam) ist das ε-Lactam der Aminosäure L-Lysin, das bei den meisten Herstellverfahren als Racemat [1:1-Gemisch aus (R)-(+)- und (S)-(–)-Aminocaprolactam] anfällt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
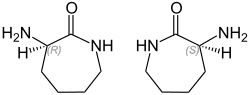 | |||||||||||||||||||
| (R)-(+)-Form (links) und (S)-(–)-Form (rechts) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3-Amino-2-azepanon | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H12N2O | ||||||||||||||||||
| Kurzbeschreibung |
weißliches[1] bis schwach gelbes Kristallpulver,[2] bzw. lange weiße Nadeln[3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | |||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser, wenig löslich in Ethanol und unlöslich in organischen Lösungsmitteln[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Während DL-Aminocaprolactam früher als chemischer Rohstoff für das heutzutage ausschließlich auf biotechnologischem Wege produzierte L-Lysin diente,[4] wird in der aktuellen Literatur α-Amino-ε-caprolactam als Zwischenstufe bei der Synthese von ε-Caprolactam und Polyamid 6 aus Biomasse diskutiert.[5]
Darstellung
DL-Aminocaprolactam wurde schon 1905 von Emil Fischer als „Lysin-anhydrid“ bei Erhitzen von DL-Lysin-methylester in Substanz mit Natriummethanolat auf 100 °C synthetisiert, aber für das aus zwei Molekülen Lysin gebildete disubstituierte Diketopiperazin gehalten.[6]
D.W. Adamson fand 1943, dass Fischers „Lysin-anhydrid“ zu 40 % aus von ihm als „dl-3-aminohomopiperidone“ bezeichneten DL-Aminocaprolactam (aus einem Molekül Lysin gebildet) bestand,[3] aus dem bereits E. Fischer das reine DL-Aminocaprolactam-Hydrochlorid dargestellt hatte.

Ausgehend von dem in großen Mengen preisgünstig zur Verfügung stehenden ε-Caprolactam, gelangt man über einen mehrstufigen Prozess beginnend mit der dreifachen Chlorierung mit Phosphoroxychlorid, Phosphorpentachlorid und Sulfurylchlorid zunächst zum α,α-Dichlor-ε-caprolactimchlorid, das mit Wasser zu α,α-Dichlor-ε-caprolactam zersetzt wird (75–80 % Ausbeute). Hydrierung in Gegenwart von Raney-Nickel in Methanol/Triethanolamin liefert DL-α-Chlor ε-caprolactam (85–90 % Ausbeute), das mit Natriumazid zum DL-α-Azido-ε-caprolactam (80–85 % Ausbeute) reagiert. Katalytische Hydrierung des Azids mit Raney-Nickel erzeugt das Zielprodukt DL-α-Amino-ε-caprolactam (90–94 % Ausbeute).[4]
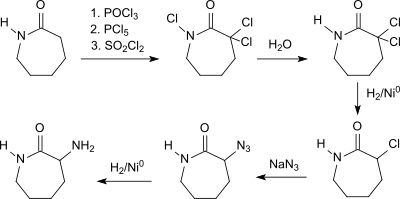
Die Gesamtausbeute von 46 bis 58 % über alle Stufen macht diesen Prozess wirtschaftlich uninteressant.
Die Trennung des anfallenden Racemats erfolgt durch Bildung des diastereomeren Salzes mit L-(–)-Pyrrolidoncarbonsäure in Ethanol, aus dem das L,L-Salz spontan auskristallisiert, und anschließende Zerlegung des isomerenreinen Salzes in 1,4-Dioxan durch Einleiten von Chlorwasserstoffgas.[7]
Ein anderer Syntheseweg, ausgehend von ε-Caprolactam, beinhaltet die Reaktion mit Phosgen zum 2-Chlorazacyclo-2,3-hepten-1-carbochlorid,[8] das zunächst mit Nitriersäure zum 3-Nitro-2-azepanon-1-carbochlorid nitriert wird,[9] und mit Wasser unter Abspaltung von Kohlendioxid und Chloridionen zum 3-Nitro-ε-caprolactam reagiert.[10] Die Hydrierung des erhaltenen racemischen 3-Nitrocaprolactams zum DL-3-Amino-ε-caprolactam erfolgt bei ca. 100 °C und ca. 150 atm Wasserstoffdruck an einem Palladium-Aktivkohle-Katalysator praktisch quantitativ.[11]
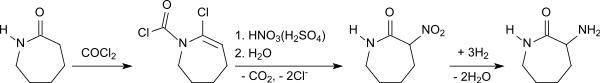
Die Spaltung des racemischen DL-3-Amino-ε-caprolactams kann durch Salzbildung mit L-5-Pyrrolidon-2-carbonsäure durchgeführt werden.[12]
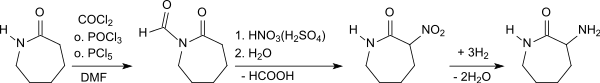
Phosgen[13] bzw. Phosphoroxychlorid oder Phosphorpentachlorid[14] und Dimethylformamid reagieren zu dem so genannten Vilsmeier-Reagenz, das mit ε-Caprolactam in Chloroform das 1-Formyl-ε-caprolactam bildet und anschließend mit Nitriersäure zum 1-Formyl-3-nitro-azacycloheptanon umgesetzt wird. Die Formylgruppe wird durch Erhitzen mit Wasser zum 3-Nitrocaprolactam abgespalten, das anschließend mit Raney-Nickel oder Palladium/Aktivkohle katalysiert zum DL-3-Aminocaprolactam hydriert wird. Mit einem chiralen Rutheniumkatalysator, wie z. B. Ru2Cl4(diop)3, kann racemisches 3-Nitrocaprolactam asymmetrisch zu 3-Aminocaprolactam hydriert werden – allerdings nur mit einem Enantiomerenüberschuss (ee) von 39 % – aus dem durch saure Hydrolyse L-Lysin-dihydrochlorid erhalten wird.[15]
Eine Lactamisierung von Lysin ohne Racemisierung kann durch Erhitzen von L-Lysin-Hydrochlorid in Xylol mit Hexamethyldisilazan (HMDS) als Kondensationsmittel für 48 Stunden in einer Eintopfreaktion unter intermediärer Bildung des Trimethylsilyl-aminosäureesters zum (S)-α-Amino-ε-caprolactam-Hydrochlorid in 82%iger Ausbeute herbeigeführt werden.[16]
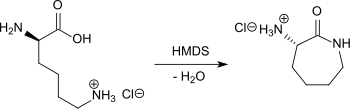
Beim Erhitzen von L-Lysin unter Rückfluss für 20 Stunden in Toluol am Wasserabscheider unter Zusatz von neutralem Aluminiumoxid wird 3-Amino-2-azepanon in 71%iger Ausbeute erhalten, allerdings ist das Endprodukt zu 41 % racemisiert.[17]
Eine Kombination von chemischer Synthese und enzymatischer Spaltung geht aus von dem petrochemischen Rohstoff Cyclohexen, das mit Nitrosylchlorid unter Lichtbestrahlung in Gegenwart von Chlorwasserstoff zu 1-Chlorcyclohexanonoxim reagiert.[18]
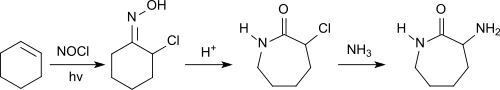
Nach Beckmann-Umlagerung des Oxims zum Lactam wird bei dem Austausch des Chloratoms durch eine Aminogruppe mittels Ammoniak DL-α-Amino-ε-caprolactam erhalten, das mit dem Enzym L-Aminocaprolactam-Hydrolase zum L-Lysin gespalten wird. Das nicht umgesetzte D-α-Amino-ε-caprolactam kann durch eine α-Amino-ε-caprolactam-racemase in das DL-α-Amino-ε-caprolactam racemisiert werden.[19]
Als einfachste und preisgünstige chemische Reaktionsvariante erscheint die Umsetzung von L-Lysin-Hydrochlorid und Natronlauge in äquimolaren Mengen in höhersiedenden Alkoholen, wie z. B. 1-Hexanol oder 1,2-Propandiol für ca. 8 Stunden unter Rückfluss und Wasserabscheidung, wobei nach Zugabe von Salzsäure kristallines DL-α-Amino-ε-caprolactam-Hydrochlorid in ca. 75%iger Ausbeute erhalten wird.[5]
Deaminierung mit Hydroxylamin-O-sulfonsäure führt zum ε-Caprolactam in 75%iger Ausbeute. Mit dieser Reaktionsfolge ist ε-Caprolactam, das Monomer für das technische Polymer Nylon 6, aus Biomasse zugänglich.[5]
Solange der Preis für das Deaminierungsreagenz Hydroxylamin-O-sulfonsäure in der letzten Reaktionsstufe höher ist als der des Endprodukts ε-Caprolactam, ist mit der kommerziellen Verwertung dieses mehrstufigen Verfahrens nicht zu rechnen.
Eigenschaften
3-Amino-2-azepanon ist ein weißer bis gelblicher kristalliner Feststoff, der in Substanz hygroskopisch ist und wässriger Lösung stark basisch reagiert. Die Aminoverbindung wird oft auch als besser kristallisierbares und handhabbares Hydrochlorid (DL-α-Amino-ε-caprolactam-Hydrochlorid, CAS # 29426-64-0) – z. B. aus methanolischer Lösung durch Einleiten von trockenem Chlorwasserstoff ausfallend – isoliert,[3] das in Wasser „spielend leicht löslich“ und in Methanol und Ethanol leicht löslich ist.[6]
Salzsäure spaltet den Lactamring und zersetzt 3-Amino-2-azepanon rasch zu DL-Lysin-Hydrochlorid.
Verwendung
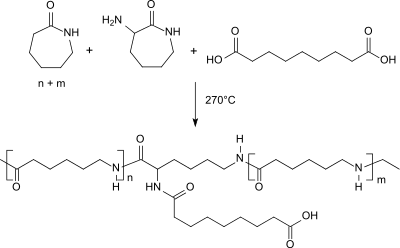
Die Zugabe von kleinen Mengen an α-Amino-ε-caprolactam, zusammen mit äquimolaren Mengen an Dicarbonsäuren, wie z. B. Azelainsäure, bei der ringöffnenden Polymerisation von Caprolactam führt nach deutlich kürzeren Reaktionszeiten zu (Co)Polyamid 6-Typen, die in Festphase zu hochmolekularen verzweigten, aber m-Kresol-löslichen Produkten mit erhöhter Schmelzviskosität nachkondensiert werden können.[20]
Die Synthese und Eigenschaften von oligomeren Epoxid/Amin-Addukten mit den aus biologischen Vorstufen abgeleiteten Aminen N-Isopropylacrylamid (aus der Aminosäure Glycin) bzw. α-Amino-ε-caprolactam (aus Lysin) und dem Diepoxid Glycerindiglycidylether wurden kürzlich beschrieben.[21]
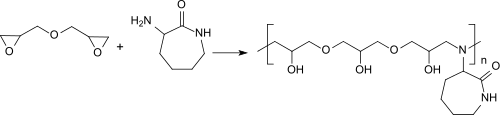
Die wasserlöslichen und thermoresponsiven Oligomeren zeigen insbesondere in Gegenwart von methylierten Cyclodextrinen als Lösungsvermittler deutliche Unterschiede in der Aushärtezeit, Viskosität und Steifigkeit.
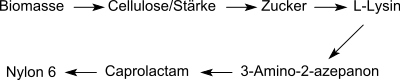
Vor dem Siegeszug der biochemischen Synthese von L-Lysin durch Fermentation war 3-Amino-2-azepanon als Zwischenstufe einer industriellen chemischen Synthese von L-Lysin – ausgehend von ε-Caprolactam aus dem petrochemischen Rohstoff Cyclohexan – von gewissem Interesse.
Das Konzept der Bioraffinerie basiert auf der Substitution von Zwischenprodukten aus petrochemischen Rohstoffen durch Analoga aus Biomasse über enzymatische Transformationen in Umkehrung konventioneller Synthesechemie: im konkreten Fall also der Umwandlung von L-Lysin über das Zwischenprodukt 3-Aminocaprolactam zum ε-Caprolactam als Monomer für den technischen Kunststoff Polyamid 6. Die bisher dazu vorgeschlagenen Syntheserouten sind mit der konventionellen Synthese noch nicht konkurrenzfähig.
Einzelnachweise
- Datenblatt 3-Amino-2-azepanone bei Sigma-Aldrich, abgerufen am 24. September 2015 (PDF).
- Eintrag zu DL-α-Amino-ε-caprolactam bei TCI Europe, abgerufen am 12. Juli 2016.
- D.W. Adamson: 13. The anhydrides of basic amino-acids. In: J. Chem. Soc. 1943, S. 39–40, doi:10.1039/JR9430000039.
- Patent DE1115257: Verfahren zur Herstellung von D,L-α-Amino-ε-caprolactam. Angemeldet am 14. März 1958, veröffentlicht am 19. Oktober 1961, Anmelder: J.R. Geigy A.-G., Erfinder: C.M. Brenner, H.-R. Rickenbacher.
- Patent US8367819: Synthesis of caprolactam from lysine. Angemeldet am 11. Juli 2011, veröffentlicht am 5. Februar 2013, Anmelder: Board of Trustees of Michigan State University, Erfinder: J.W. Frost.
- E. Fischer, U. Suzuki: Synthese von Polypeptiden. X. Polypeptide der Diamino- und Oxyamino-Säuren. In: Ber. Dtsch. Chem. Ges. Band 38, Nr. 4, 1905, S. 4173–4196, doi:10.1002/cber.190503804101.
- Patent DE1194864: Verfahren zur Herstellung von L-(-)-α-Amino-ε-caprolactam und dessen Salzen. Angemeldet am 14. März 1958, veröffentlicht am 19. März 1970, Anmelder: J.R. Geigy A. G., Erfinder: C.M. Brenner, H.-R. Rickenbacher.
- Patent US3080358: Preparation of azacyclo-2,3-alkene-2-chloro-N-carbochloride. Angemeldet am 18. September 1958, veröffentlicht am 5. März 1963, Anmelder: Stamicarbon N.V., Erfinder: J.H. Ottenheym, J.W. Garritsen.
- Patent US3093634: Preparation of α-Nitrolactams. Angemeldet am 10. September 1959, veröffentlicht am 11. Juni 1963, Anmelder: Stamicarbon N.V., Erfinder: J.H. Ottenheym, J.P.H. von den Hoff.
- Patent US3096326: Preparation of α-Nitro-ε-caprolactam. Angemeldet am 19. Februar 1962, veröffentlicht am 2. Juli 1963, Anmelder: Stamicarbon N.V., Erfinder: J.de Haan, J.P.H. von den Hoff.
- Patent US3048580: Preparation of α-Aminolactams by catalytic hydrogenation of α-Nitrolactams. Angemeldet am 10. September 1959, veröffentlicht am 7. August 1962, Anmelder: Stamicarbon N.V., Erfinder: J.H. Ottenheym, P.L. Kerkhoffs.
- Eberhard Breitmaier, Günther Jung: Organische Chemie: Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur, 5. überarb. Auflage. Thieme, 2005, ISBN 3-13-541505-8, S. 782, doi:10.1016/j.tet.2005.08.031.
- Patent US3687940: Process for the production of 3-Amino-azacycloheptan-2-one. Angemeldet am 24. Juni 1970, veröffentlicht am 29. August 1972, Anmelder: Ciba-Geigy Corp., Erfinder: V.R. Foitl, W. Traber.
- Patent US3557093: 1-Formyl-3-nitro-azacycloheptan-2-ones and process for their production. Angemeldet am 24. Juni 1970, veröffentlicht am 29. August 1972, Anmelder: Ciba-Geigy Corp., Erfinder: V.R. Foitl, W. Traber.
- Patent EP0083332: Asymmetric reduction of nitro-containing prochiral compounds. Angemeldet am 20. Dezember 1982, veröffentlicht am 6. Juli 1983, Anmelder: Monsanto Co., Erfinder: G.L. Bachman, M.J. Sabacky.
- R. Pellegata, M. Pinza, G. Pifferi: An improved synthesis of γ-, δ-, and ε-lactams. In: Synthesis. 1978, S. 614–616, doi:10.1055/s-1978-24834.
- A. Bladé-Font: Facile synthesis of γ-, δ-, and ε-lactams by cyclodehydration of α-amino acids on alumina and silica gels. In: Tetrahedron Lett. Band 21, Nr. 25, 1980, S. 2443–2446, doi:10.1016/S0040-4039(00)93171-X.
- M. Ohno, N. Naruse, S. Torimitsu, M. Okamoto: Reactions of 2-Chlorocycloalkanone Oximes. I. Their Preparations and Conversion to 2-Alkoxy-, 2-Acyloxy- and 2-Alkylthiocycloalkanone Oximes. In: Bull. Chem. Soc. Band 39, Nr. 6, 1966, S. 1119–1124, doi:10.1246/bcsj.39.1119.
- Y. Isumi, I. Chibata, T. Itoh: Herstellung und Verwendung von Aminosäuren. In: Angew. Chem. Band 90, Nr. 3, 1978, S. 187–194, doi:10.1002/ange.19780900307.
- Patent EP0288894: Alpha-amino-epsilon-caprolactam modifizierte Polyamide. Angemeldet am 2. November 1988, veröffentlicht am 25. September 1991, Anmelder: Bayer AG, Erfinder: Dr. Rolf-Volker Meyer, Dr. Rolf Dhein, Dr. Martin Wandel, Dr. Harald Selbeck, Dipl.-Ing. Friedrich Fahnler, Dr. Hans-Detlef Heinz, Dr. Peter-Rolf Müller.
- J. Fischer, H. Ritter: Oligomeric epoxide-amine adducts based on N-isopropylacrylamide and α-amino-ε-caprolactam: Solubility in presence of cyclodextrin and curing properties. In: Beilstein J. Org. Chem. Band 9, 2013, S. 2803–2811, doi:10.3762/bjoc.9.315.
