Thermoresponsive Polymere
Thermoresponsive Polymere sind Polymere, die ihre physikalischen Eigenschaften drastisch und diskontinuierlich mit der Temperatur ändern.[1] Der Begriff wird meist verwendet, wenn die betroffene Eigenschaft die Löslichkeit in einem bestimmten Lösungsmittel ist, muss jedoch nicht darauf beschränkt bleiben. Thermoresponsive Polymere gehören zur Klasse der stimuliresponsiven Materialien, in Abgrenzung zu sensitiven Materialien, welche ihre Eigenschaften nur kontinuierlich den äußeren Bedingungen anpassen. Außerdem handelt es sich um Funktionspolymere.
Thermoresponsive Polymere im engeren Sinne weisen in ihrem Temperatur-Zusammensetzungs-Diagramm eine Mischungslücke auf. Je nachdem, ob die Mischungslücke bei hoher oder niedriger Temperatur auftritt, existiert eine untere oder obere kritische Lösungstemperatur (engl. lower or upper critical solution temperature, abgekürzt LCST oder UCST). Nach der geläufigen englischen Abkürzung werden die betreffenden Polymere oft kurz als LCST- oder UCST-Polymere bezeichnet.
Im Fokus der Forschung stehen vor allem Polymere, die Thermoresponsivität in wässriger Lösung aufweisen. Als vielversprechende Einsatzfelder werden Tissue Engineering[2], Chromatographie[3], Wirkstofffreisetzung[2][4] und Bioseparation[5] gesehen. Kommerzielle Anwendungen gibt es bisher wenige. Ein Beispiel sind Zellkulturplatten, welche mit LCST-Polymeren beschichtet sind.
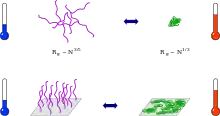
Der Knäuel-Globuli-Übergang
Thermoresponsive Polymere liegen in Lösung als offenkettige Knäuel vor. Bei der Phasenseparationstemperatur kollabieren diese zu kompakten Globuli (engl. coil-to-globuli transition). Durch Methoden der statischen und dynamischen Lichtstreuung kann dieser Prozess direkt beobachtet werden.[6][7] Indirekt kann der Abfall der Viskosität verfolgt werden. Sind keine Mechanismen vorhanden, um die Oberflächenspannung zwischen Globuli und Lösungsmittel zu minimieren, kommt es zur Aggregation der Globuli, was sich zunächst in zunehmender Trübung der Lösung und schließlich in der Bildung sichtbarer Partikel äußert.
Das Phasendiagramm thermoresponsiver Polymere
Die Phasenseparationstemperatur (und damit auch der Trübungspunkt) ist abhängig von der Polymerkonzentration. Deshalb werden Temperatur-Zusammensetzungs-Diagramme verwendet, um das thermoresponsive Verhalten über einen weiten Konzentrationsbereich darzustellen.[8] Phasenseparation erfolgt in eine polymerarme und eine polymerreiche Phase. In strikt binären Mischungen könnte die Zusammensetzung der koexistierenden Phasen durch Bildung der Konode bestimmt werden (siehe kritische Lösungstemperatur). Da Polymere in der Regel eine Molmassenverteilung aufweisen, ist dieses einfache Verfahren nur noch bedingt anwendbar.
Im Zuge der Phasenseparation kann es passieren, dass die polymerreiche Phase glasartig erstarrt, bevor der Gleichgewichtszustand erreicht ist. Dies ist abhängig von der Glasübergangstemperatur bei der jeweiligen Zusammensetzung des Gemischs. Es ist zweckmäßig, die Entwicklung der Glasübergangstemperaturen im Phasendiagramm darzustellen, obwohl es sich nicht um einen Gleichgewichtszustand handelt. Der Schnittpunkt zwischen Glaspunktkurve und Trübungspunktkurve wird Berghmans-Punkt genannt.[9] Im Falle von UCST-Polymeren erfolgt oberhalb des Berghmans-Punktes Phasenseparation in zwei flüssige Phasen, unterhalb in eine flüssige polymerarme Phase und eine glassartig erstarrte polymerreiche Phase. Für LCST-Polymere wird das inverse Verhalten beobachtet.
Thermodynamik
Polymere lösen sich in einem Lösungsmittel, wenn sich dadurch die Gibbs-Energie des Systems verringert, d. h. die Änderung der Gibbs-Energie (ΔG) negativ ist. Aus der bekannten Legendre-Transformation der Gibbs-Helmholtz-Gleichung geht hervor, dass ΔG aus der Mischungsenthalpie (ΔH) und Mischungsentropie (ΔS) zusammengesetzt ist.
Würden keine Wechselwirkungen zwischen den beteiligten Stoffen bestehen, so wäre keine Mischungsenthalpie vorhanden und die Mischungsentropie wäre ideal. Die ideale Mischungsentropie von mehreren Reinstoffen ist immer positiv (der Term -T·ΔS dann negativ) und ΔG wäre bei jedem Mischungsverhältnis negativ. Es wäre vollständige Mischbarkeit gegeben. Daraus folgt, dass Mischungslücken mit Wechselwirkungen zwischen den Komponenten erklärt werden müssen. Im Falle einer Polymerlösung müssen Polymer-Polymer, Lösungsmittel-Lösungsmittel und Polymer-Lösungsmittel-Wechselwirkungen berücksichtigt werden. Ein Modell zur phänomenologischen Beschreibung von Polymerphasendiagrammen wurde von Flory und Huggins entwickelt (siehe Flory-Huggins-Theorie).

Aus der Flory-Huggins-Theorie folgt zum Beispiel, dass die UCST (falls vorhanden) sich mit zunehmender molarer Masse erhöht und sich gleichzeitig in die lösungsmittelreiche Zone verschiebt. Ob ein Polymer LCST- und/oder UCST-Verhalten aufweist, lässt sich aus der Temperaturabhängigkeit des Wechselwirkungsparameters ableiten (siehe Abbildung). Es ist zu beachten, dass der Wechselwirkungsparameter nicht nur enthalpische Elemente enthält, sondern auch die nicht-ideale Mischungsentropie (z. B. den sehr starken hydrophoben Effekt in wässriger Lösung). Da der Wechselwirkungsparameter sowohl enthalpische als auch entropische Elemente enthält, die wiederum aus vielen Einzelkomponenten zusammengesetzt sind, lässt die klassische Flory-Huggins-Theorie nur schwer Rückschlüsse auf die molekulare Ursache von Mischungslücken zu.
Anwendungen
Bioseparation
Thermoresponsive Polymere können mit funktionellen Gruppen ausgestattet werden, die spezifisch an bestimmte Biomoleküle binden. Diese Biomoleküle können dann durch eine geringfügige Temperaturänderung zusammen mit dem Polymer ausgefällt werden.[10][5] Eine Isolation ist durch Filtration oder Zentrifugation möglich.
Thermoresponsive Oberflächen in Tissue Engineering und Chromatographie
Für einige Polymere konnte demonstriert werden, dass thermoresponsives Verhalten auf Oberflächen übertragen werden kann. Hierzu kann die Oberfläche entweder mit einem Polymerfilm beschichtet oder die Polymerketten kovalent an die Oberfläche gebunden werden. Die Benetzung der Oberfläche mit dem Lösungsmittel kann so durch kleine Temperaturänderungen gesteuert werden. Das beschriebene Verhalten kann beispielsweise im Tissue Engineering ausgenutzt werden, da die Adhesion von Zellen an Oberflächen stark von der Hydrophilie/Hydrophobie der Oberfläche abhängt.[2] So ist es möglich, Zellen, ohne den sonst üblichen Einsatz von Enzymen, durch eine kleine Temperaturänderung von einer entsprechend beschichteten Zellkulturplatte abzulösen. Entsprechende Produkte sind bereits kommerziell erhältlich.
Ebenfalls untersucht wird der Einsatz thermoresponsiver Polymere als stationäre Phase in der Flüssigchromatographie.[3] Die Polarität der stationären Phase kann hier durch eine Temperaturänderung extrem beeinflusst werden, wodurch die Trennwirkung für verschiedene Stoffklassen ohne Säulenwechsel variiert werden kann.
Thermoresponsive Gele
Dreidimensionale Polymernetzwerke sind in allen Lösungsmitteln unlöslich, sie können lediglich eine Quellung aufweisen. Thermoresponsive Polymere zeigen einen diskontinuierlichen Verlauf des Quellgrads mit der Temperatur. Bei der Volumen-Phasenübergangs-Temperatur (engl. volume phase transition temperature, VPTT) tritt eine starke Änderung des Quellgrades ein. Zahlreiche Forschungsarbeiten versuchen dieses Verhalten für die temperaturinduzierte Wirkstofffreisetzung zu nutzen, da zuvor eingelagerte Wirkstoffe im gequollenen Zustand leicht aus Gel diffundieren können.[11]
Charakterisierung von thermoresponsiven Polymerlösungen
Trübungspunkt (engl. cloud point)
Experimentell kann die Phasenseparation einfach durch Turbidimitrie untersucht werden. Es gibt keine Vorgehensweise zur Bestimmung des Trübungspunktes, die für alle Systeme gleichermaßen zweckmäßig ist. Daher existiert keine einheitliche Definition. Häufig wird er definiert als die Temperatur, bei der eine erste Trübung zu detektieren ist (onset), die Temperatur am Wendepunkt der Transmissionskurve oder die Temperatur bei einer definierten Transmission (z. B. 50 %).[9] Ebenfalls undefiniert ist die Bezeichnung für die Temperatur beim Wiederaufklaren der Lösung, da der Begriff Klärpunkt schon für Phasenübergänge bei Flüssigkristallen verwendet wird.
Hysterese
Die Trübungspunkte (bzw. „Klärpunkte“) beim Abkühlen und Aufheizen einer thermoresponsiven Polymerlösung sind nicht identisch, weil die Gleichgewichtseinstellung Zeit benötigt. Das Temperaturintervall zwischen den Trübungspunkten in Kühl- und Heizphase wird Hysterese genannt. Die Trübungspunkte sind abhängig von der verwendeten Kühl- bzw. Heizrate und die Hysterese verringert sich mit abnehmenden Raten. Es wird vermutet, dass die Hysterese abhängig ist von der Temperatur, Viskosität, Glasübergangstemperatur und der Fähigkeit, im phasenseparierten Zustand zusätzliche intra- und intermolekulare Bindungen auszubilden.[12]
Weitere Eigenschaften
Von sehr großer Bedeutung für potentielle Anwendungen ist, wie stark sich der Polymergehalt der beiden Phasen nach der Separation unterscheidet. Für die meisten Anwendungen wäre eine Phasentrennung in reines Polymer und reines Lösungsmittel wünschenswert, praktisch ist dies jedoch nicht möglich. Der Verlauf der Phasentrennung hängt von der genauen Form des Phasendiagramms ab.
Beispiel: Aus dem Phasendiagramm einer Lösung von Polystyrol (molare Masse 43.600 g/mol) im Lösungsmittel Cyclohexan lässt sich ableiten, dass bei einer Gesamtpolymerkonzentration von 10 % beim Abkühlen von 25 auf 20 °C eine polymerarme Phase mit ca. 1 % Polymer und eine polymerreiche Phase mit ca. 30 % Polymer entsteht.[13]
Ebenfalls wünschenswert für viele Anwendungen ist ein scharfer Phasenübergang, was sich in einem abrupten Abfall der Transmissionskurve äußert. Die Schärfe des Phasenübergangs hängt mit der Stärke der Phasenseparation zusammen, wird aber zusätzlich davon beeinflusst, ob alle in der Mischung vorliegenden Polymerketten den gleichen Trübungspunkt haben. Dies ist abhängig von den Polymerendgruppen, der Dispersität und ggf. von variierendern Copolymerzusammensetzungen.[12]
Beispiele thermoresponsiver Polymere
Thermoresponsivität in organischen Lösungsmitteln
Aufgrund der geringen Mischungsentropie treten Mischungslücken bei Polymerlösungen relativ häufig auf.[8] Es sind sehr viele Polymere bekannt, die in organischen Lösungsmitteln UCST und/oder LCST-Verhalten zeigen.[14] Als Beispiele für organische Polymerlösungen mit UCST seien Polystyrol in Cyclohexan[13][15], Polyethylen in Diphenylether[16][17] oder Polymethylmethacrylat in Acetonitril[18] genannt. Eine LCST findet man beispielsweise für die Systeme Polypropylen in n-Hexan[19], Polystyrol in Butylacetat[20] oder Polymethylmethacrylat in 2-Propanon.[21]
Thermoresponsivität in Wasser
Polymerlösungen, die Thermoresponsivität in Wasser zeigen, sind von besonderer Bedeutung, da das Lösungsmittel Wasser günstig, sicher und biologisch relevant ist. In der Wissenschaft wird seit Längerem versucht, wasserlösliche thermoresponsive Polymere für die Wirkstofffreisetzung oder intelligente Materialien im Tissue Engineering nutzbar zu machen. Viele Polymere mit LCST in Wasser sind bekannt.[9] Am besten untersucht ist Poly-N-Isopropylacrylamid.[22][23] Weitere Beispiele sind Hydroxypropylcellulose[24], Poly(vinylcaprolactam)[25] und Polyvinylmethylether.[26]
Eine Reihe von großtechnisch hergestellten Polymeren zeigen neben LCST- auch UCST-Verhalten in Wasser. Allerdings befindet sich die UCST meist in Temperaturbereichen außerhalb des 0–100-°C-Spektrums und kann somit nur unter extremen Versuchsbedingungen festgestellt werden.[12] Beispiele sind Polyethylenoxid[27][28], Polyvinylmethylether[29][30] und Polyhydroxyethylmethacrylat.[31] Es gibt auch Beispiele für Polymere, die UCST-Verhalten im Bereich zwischen 0 und 100 °C aufweisen.[12] Hier gibt es jedoch große Unterschiede bezüglich der Ionenstärke, bei der UCST-Verhalten beobachtet werden kann. Einige Polyzwitterionen zeigen UCST-Verhalten in reinem Wasser, nicht jedoch in salzhaltigem Wasser.[32] Polyacrylsäure hingegen zeigt UCST-Verhalten ausschließlich bei hohen Ionenstärken.[33] Beispiele von Polymeren, die sowohl in reinem Wasser als auch unter physiologischen Bedingungen UCST-Verhalten zeigen können, sind Poly(N-acrylglycinamid)[34][35], Harnstoff-funktionalisierte Polymere[36] und Copolymere aus Acrylamid und Acrylnitril.[37] Für die Feststellung von Trübungspunkten in reinem Wasser gilt allerdings, dass die Polymere keine ionischen Gruppen enthalten dürfen.
Bei den genannten Beispielen ist zu beachten, dass die UCST abhängig von der Molmasse der Polymere ist. Bei der LCST ist dies nicht unbedingt der Fall, wie für Poly(N-isopropylacrylamid) gezeigt.[38][39]
Einzelnachweise
- Allan S. Hoffman, “Intelligent” Polymers in Medicine and Biotechnology, Artificial Organs, 1995, Volume 19, pp 458–467.
- Mark A. Ward, Theoni K. Georgiou, Thermoresponsive Polymers for Biomedical Applications, Polymers, 2011, Volume 3, S. 1215–1242.
- Irene Tan, Farnoosh Roohi, Maria-Magdalena Titirici, Thermoresponsive polymers in liquid chromatography. In: Analytical Methods, 2012, Volume 4, S. 34–43.
- A. K. Bajpai, Sandeep K. Shukla, Smitha Bhanu, Sanjana Kankane, Responsive polymers in controlled drug delivery, Progress in Polymer Science, 2008, Volume 33, S. 1088–1118.
- Igor Galaev, Bo Mattiasson, Smart Polymers for Bioseparation and Bioprocessing, CRC Press, 2001, ISBN 978-0-415-26798-4.
- C. Wu, X. Wang, Globule-to-Coil Transition of a Single Homopolymer Chain in Solution, Physical Review Letters, 1998, Volume 80, S. 4092–4094.
- S. Vshivkov, A. P. Safronov, The conformational coil-globule transition of polystyrene in cyclohexane solution, Macromolecular Chemistry and Physics, 1997, Volume 198, 3015.
- Ronald Koningsveld, Walter H. Stockmayer, Erik Nies, Polymer Phase Diagrams, Oxford University Press, Oxford, 2001, ISBN 978-0-19-855635-0.
- V. Aseyev, H. Tenhu, F. M. Winnik, Non-ionic Thermoresponsive Polymers in Water, Advances Polymer Science, 2010, Volume 242, S. 29–89.
- Jing Ping Chen, Allan S. Hoffman, Polymer-Protein Conjugates II. Affinity precipitation separation of human immunogammaglobulin by a poly(N-isopropylacrylamide)-protein A conjugate, Biomaterials, 1990, Volume 11, S. 631–634.
- R. Dinarvand, A. D'Emanuele, The use of thermoresponsive hydrogels for on-off release of molecules, Journal of Controlled Release, 1995, Volume 36, S. 221–227.
- Jan Seuring, Seema Agarwal, Polymers with Upper Critical Solution Temperature in Aqueous Solution, Macromolecular Rapid Communications, 2012, Volume 33, S. 1898–1920.
- A. R. Schultz, P. J. Flory, Phase Equilibria in Polymer-Solvent Systems, Journal of the American Chemical Society, 1952, Volume 74, S. 4760–4767.
- C. Wohlfarth, Upper Critical (UCST) and Lower Critical (LCST) Solution Temperatures of Binary Polymer Solutions, Polymer Handbook, 87th ed., CRC press, 2006, chapter 13, S. 19-34, ISBN 978-0-8493-0487-3.
- J. Hashizume, A. Teramoto, H. Fujita, Phase Equilibrium Study of the Ternary System Composed of Two Monodisperse Polystyrenes and Cyclohexane, Journal of Polymer Science, Polymer Physics Edition, 1981, Volume 19, S. 1405–1422.
- A. Nakajima, F. Hamada, S. Hayashi, Unperturbed Chain Dimensions of Polyethylene in Theta Solvents, Journal of Polymer Science, Part C: Polymer Symposium, 1966, Volume 15, S. 285–294.
- R. Koningsveld, A. J. Staverman, Liquid-Liquid Phase Separation in Multicomponent Polymer Solutions. II. The Critical State, Journal Polymer Science, Polymer Physics Editions, 1968, Volume 6, pp 325-347.
- T. G. Fox, Properties of dilute polymer solutions III: Intrinsic viscosity/temperature relationships for conventional polymethylmethacrylate, Polymer, 1962, Volume 3, S. 111–128.
- J. M. G. Cowie, I. J. McEwen, Lower critical solution temperatures of polypropylene solutions, Journal of Polymer Science: Polymer Physics Edition, 1974, Volume 12, S. 441–443.
- Oliver Pfohl, Toshiaki Hino, John M. Prausnitz, Solubilities of styrene-based polymers and copolymers in common solvents, Polymer, 1995, Volume 36, S. 2065–2073.
- J. M. G. Cowie, I J. McEwen, Influence of microstructure on the upper and lower critical solution temperatures of poly(methylmethacrylate) solutions, Journal of the Chemical Society, Faraday Transactions 1: Physical Chemistry in Condensed Phases, 1976, Volume 72, S. 526–533.
- S. Fujishige, K. Kubota, I. Ando, Phase Transition of Aqueous Solutions of Poly(N-isopropylacrylamide) and Poly(N-isopropylmethacrylamide), Journal of Physical Chemistry, 1989, Volume 93, pp 3311–3313.
- M. Heskins, J. E. Guillet, Solution Properties of Poly(Nisopropylacrylamide), Journal of Macromolecular Science: Part A - Chemistry, 1968, Volume 2, pp 1441-1455.
- A. Kagemoto, Y. Baba, Kobunshi Kagaku, 1971, Volume 28, p 784.
- Y. Maeda, T. Nakamura, I. Ikeda, Hydration and Phase Behavior of Poly(N-vinylcaprolactam) and Poly(N-vinylpyrrolidone) in Water, Macromolecules, 2002, Volume 35, pp 217-222.
- H. G. Schild, D. A. Tirrell, Microcalorimetric Detection of Lower Critical Solution Temperatures in Aqueous Polymer Solutions, Journal of Physical Chemistry, 1990, Volume 94, pp 4352-4356.
- G. N. Malcolm, J. S. Rowlinson, The Thermodynamic Properties of Aqueous Solutions of Polyethylene Glycol, Polypropylene Glycol and Dioxane, Transactions of the Faraday Society, 1957, Volume 53, pp 921-931.
- S. Saeki, N. Kuwahara, M. Nakata, M. Kaneko, Upper and lower critical solution temperatures in poly (ethylene glycol) solutions, Polymer, 1976, Volume 17, pp 685-689.
- G. V. Assche, B. Van Mele, T. Li, E. Nies, Adjacent UCST Phase Behavior in Aqueous Solutions of Poly(vinyl methyl ether): Detection of a Narrow Low Temperature UCST in the Lower Concentration Range, Macromolecules, 2011, Volume 44, pp 993-998.
- Vgl. auch Jörn F. Lübben, Daniel Crespy, Matthijs de Geus, Manfred Heuberger, Monitoring the hygrothermal response of poly (vinyl methyl ether) submicron films using AFM, European Polymer Journal, Volume 48, 1, 2012, pp 209–216.
- R. Longenecker, T. Mu, M. Hanna, N. A. D. Burke, H. D. H. Stöver, Thermally Responsive 2-Hydroxyethyl Methacrylate Polymers: Soluble-Insoluble and Soluble-Insoluble-Soluble Transitions, Macromolecules, 2011, Volume 44, pp 8962-8971.
- P. Mary, D. D. Bendejacq, M.-P. Mareau, P. Dupuis, Reconciling Low- and High-Salt Solution Behavior of Sulfobetaine Polyzwitterions, Journal of Physical Chemistry B, 2007, Volume 111, pp 7767-7777.
- R. Buscall, T. Corner, The Phase-Separation Behaviour of Aqueous Solutions of Polyacrylic Acid and its Partial Sodium Salts in the Presence of Sodium Chloride, European Polymer Journal, 1982, Volume 18, pp 967-974.
- Jan Seuring, Frank M. Bayer, Klaus Huber, Seema Agarwal, Upper Critical Solution Temperature of Poly(N-acryloyl glycinamide) in Water: A Concealed Property, Macromolecules, 2012, Volume 45, pp 374-384.
- Fangyao Liu, Jan Seuring, Seema Agarwal, Controlled Radical Polymerization of N-Acryloylglycinamide and UCST-type Phase Transition of the Polymers, Journal of Polymer Science A: Polymer Chemistry, 2012, Volume 50, pp 4920-4928.
- N. Shimada, H. Ino, K. Maie, M. Nakayama, A. Kano, A. Maruyama, Ureido-Derivatized Polymers Based on Both Poly(allylurea) and Poly(L-citrulline) Exhibit UCST-Type Phase Transition Behavior under Physiologically Relevant Conditions, Biomacromolecules, 2011, Volume 12, pp 3418-3422.
- Jan Seuring, Seema Agarwal, First Example of a Universal and Cost-Effective Approach: Polymers with Tunable Upper Critical Solution Temperature in Water and Electrolyte Solution, Macromolecules, 2012, Volume 45, pp 3910-3918.
- Karel Solc, Karel Dusek, Ronald Koningsveld, Hugo Berghmans, "Zero and Off-Zero Critical Concentrations in Solutions of Polydisperse Polymers with Very High Molar Masses, In: Collection of Czechoslovak Chemical Communications, 1995, Volume 60, pp 1661-1688.
- Fatema Afroze, Erik Nies, Hugo Berghmans, Phase transitions in the system poly(N-isopropylacrylamide)/water and swelling behaviour of the corresponding networks, Journal of Molecular Structure, 2000, Volume 554, pp 55-68.