Triethanolamin
Triethanolamin (nach IUPAC-Nomenklatur: 2,2′,2′′-Nitrilotriethanol, abgekürzt auch als TEOA bezeichnet) ist eine organisch-chemische Verbindung aus der Stoffgruppe der Aminoalkohole. Die farblose bis hellgelbe Flüssigkeit mit aminartigem Geruch wird vor allem als Vorprodukt für Seifen, Tenside und Waschmitteln sowie in der Gaswäsche eingesetzt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
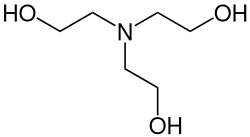 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Triethanolamin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C6H15NO3 | ||||||||||||||||||
| Kurzbeschreibung |
viskose, hygroskopische, farblose bis gelbliche Flüssigkeit[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 149,19 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
1,13 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
360 °C[3] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
7,74[4] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
DFG/Schweiz: 1 mg·m−3 (gemessen als einatembarer Staub)[3][5] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Triethanolamin wird großtechnisch durch Umsetzung von Ethylenoxid mit wässrigem Ammoniak bei Temperaturen von 60–150 °C und Drücken von 30–150 bar an sauren Kationenaustauschern hergestellt:[6]
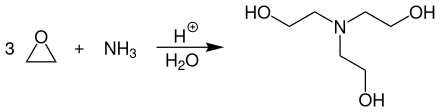
Die Reaktion wird in der flüssigen Phase und in Gegenwart von Wasser in einem Rohr- oder Rohrbündelreaktor statt. Die Katalysator ist dabei als Festbett im Reaktor angeordnet. Bei dieser Reaktion fällt praktisch immer ein Gemisch aus Mono-, Di-, und Triethanolamin an. Durch einen geeigneten Überschuss an Ethylenoxid (bzw. einen Unterschuss an Ammoniaklösung) kann der prozentuale Anteil an Triethanolamin im Produktgemisch erhöht werden.[7]
Die Trennung und Aufreinigung des Produktgemisches, welches neben den drei Ethanolaminen hauptsächlich aus Ammoniak und Wasser besteht, erfolgt für gewöhnlich destillativ in Rektifikationskolonnen. Nicht-umgesetzte Reaktanten werden bevorzugt wieder in den Reaktor zurückgeführt.[7]
Die weltweiten Herstellkapazitäten für Ethanolamine betrug im Jahr 2004 etwa 1,38 Millionen Tonnen. Die Kapazität in der Bundesrepublik Deutschland wurde auf etwa 130.000 Tonnen geschätzt.[6]
Eigenschaften
Chemische Eigenschaften
Triethanolamin reagiert mit Fettsäuren leicht zu Triethanolaminseifen, welche nicht nur in Wasser, sondern auch in Mineralölen leicht löslich sind. In wässriger Lösung reagiert es stark basisch.
Verwendung
Man verwendet Triethanolamin als basische Komponente in Seifen und Kosmetik, als Netzmittel für Textilien, als Weichmacher in der Lederindustrie, als Korrosionsinhibitor oder als Zwischenprodukt zur Herstellung von Seifen, Dispergiermitteln und wasserlöslichen Herbiziden sowie bei der Herstellung von Zement als Mahlhilfsmittel. In der Holographie wird es zum Verschieben der Rekonstruktionsfarbe verwendet. Außerdem verwendet man Triethanolamin auch bei der Ammoniak-Synthese als Katalysatorentgifter, da Triethanolamin stark CO2 anziehend ist. Weiterhin ist es ein pharmazeutischer Hilfsstoff, beispielsweise in Arzneimittelgelen.
Triethanolamin kann auch als Ausgangsstoff bei der Synthese von HN-3, einem Stickstofflost verwendet werden. Dabei handelt es sich um eine im Ersten Weltkrieg eingesetzte Chemische Waffe. Aus diesem Grund findet sich der Stoff in Liste 3 der Chemiewaffenkonvention und Produktionen ab einer Jahresmenge von 30 t sind meldepflichtig, sowie die Ausfuhr in Staaten die die Konvention nicht unterzeichnet haben, verboten.[8]
Zur Bestimmung der Belastung der Außenluft mit Stickstoffdioxid wird dieses in einem Passivsammler mit Triethanolamin zur Reaktion gebracht. Das bei der Reaktion entstehende Nitrit wird extrahiert und anschließend mittels Kolorimetrie und Ionenchromatographie analysiert.[9]
Gesundheitsgefahren / Risikobewertung
Die Dämpfe reizen die Augen und die Atemwege. Es weist eine geringe Giftigkeit auf (LD50 oral Ratte > 5000 mg/kg, LD50 dermal Kaninchen > 2000 mg/kg)
Triethanolamin wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Triethanolamin waren die Besorgnisse bezüglich Verbraucherverwendung, Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage, anderer gefahrenbezogener Bedenken und weit verbreiteter Verwendung sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der CMR-Substanzen und der möglichen Gefahr durch sensibilisierende Eigenschaften. Die Neubewertung fand ab 2014 statt und wurde vom Vereinigten Königreich durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht, in dem keine Änderungen gegenüber der bestehenden Einstufung empfohlen wurden.[10][11]
Einzelnachweise
- Eintrag zu TRIETHANOLAMINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 17. Februar 2020.
- Eintrag zu 2,2′,2′′-Nitrilotriethanol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Mai 2014.
- Eintrag zu 2,2′,2′′-Nitrilotriethanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. April 2017. (JavaScript erforderlich)
- Simond, M. R.: Dissociation Constants of Protonated Amines in Water at Temperatures from 293.15 K to 343.15 K. In: Journal of Solution Chemistry. 41, 2012, S. 130. doi:10.1007/s10953-011-9790-3.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 102-71-6 bzw. Triethanolamin), abgerufen am 15. März 2019.
- Hans-Jürgen Arpe: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte. 6. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6, S. 172 f.
- Patent WO2019154647A1: Verfahren zur Herstellung von C2-C4-Monoalkanolaminen mittels eines sauren Kationenaustauschers als Katalysator. Veröffentlicht am 15. August 2019, Anmelder: BASF SE, Erfinder: Christian Gruenanger, Gabriele Iffland, Zeljko Kotanjac, Hermann Luyken, Thomas Krug, Jian Zhong Yi, Johann-Peter Melder.
- Chemiewaffenkonventionen-Durchführungsgesetz
- DIN EN 16339:2013-11 Außenluft; Bestimmung der Konzentration von Stickstoffdioxid mittels Passivsammler; Deutsche Fassung EN 16339:2013. Beuth Verlag, Berlin, S. 7.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Report und Conclusion Document.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): 2,2′,2′′-nitrilotriethanol, abgerufen am 26. März 2019.