2-Ethylhexylamin
2-Ethylhexylamin (2-EHA) ist ein wenig wasserlösliches primäres Amin, das sich von dem racemischen 2-Ethylhexanol ableitet und dessen C8-Alkylrest in 2-Stellung mit einer Ethylgruppe verzweigt ist. Wegen seiner einfachen Zugänglichkeit findet 2-EHA als Amin mittlerer Kettenlänge vielfältige Verwendung.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
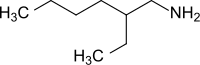 | ||||||||||||||||
| Vereinfachte Strukturformel – Isomerengemisch | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2-Ethylhexylamin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H19N | |||||||||||||||
| Kurzbeschreibung |
klare farblose bis hellgelbe[1] Flüssigkeit mit stechendem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 129,25 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Herstellung
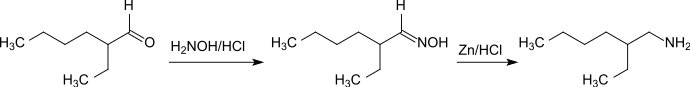
Die Aminierung von 2-Ethylhexanal durch Umsetzung mit Hydroxylaminhydrochlorid zum Oxim und anschließender Reduktion mit Zink-Salzsäure stellt eine einfache Eintopfmethode zur Darstellung von racemischem 2-Ethylhexylamin dar.[5]
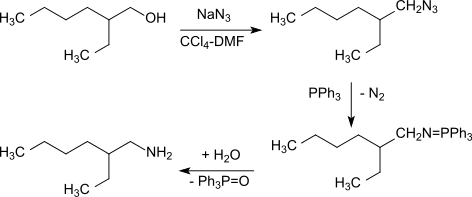
Aus 2-Ethylhexanol ist das Amin auch durch Eintopfreaktion mit Natriumazid in Gegenwart von zweimolarem Triphenylphosphin im System Tetrachlorkohlenstoff/N,N-Dimethylformamid (1:4) bei 90 °C über das intermediär entstehende Azid in einer Staudinger-Reaktion in Ausbeuten von 85–95 % zugänglich.[6][7]
Von industriellem Interesse ist die reduktive Aminierung beim Überleiten von 2-Ethylhexanol mit Ammoniak in der Dampfphase über Kupfer- und Nickel-Kontakten bei Temperaturen über 200 °C und kurzen Kontaktzeiten (5–15 sec), die ein Gemisch aus 2-Ethylhexylamin (23 % Ausbeute), Di-(2-ethylhexyl)amin (71 % Ausbeute) und Tri-(2-ethylhexyl)amin (2 % Ausbeute) liefert.[8]
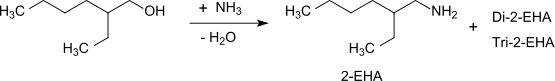
Erhöhung des Ammoniak- und Wasserstoffüberschusses führt zu einer deutlichen Verschiebung der Gemischzusammensetzung in Richtung des Monosubstitutionsprodukts 2-Ethylhexylamin und zur vollständigen Hydrierung des intermediär gebildeten Nitrils.
Für die destillative Aufarbeitung ist wegen der relativ geringen Siedepunktsdifferenz (2-EH-amin 169 °C) die möglichst vollständige Umsetzung des eingesetzten 2-EH-OHs (Sdp. 182 °C) vorteilhaft.
Eigenschaften
2-Ethylhexylamin ist eine klare, farblose, stechend fischartig bzw. nach Ammoniak riechende Flüssigkeit, die stark ätzend und sehr augen- und schleimhautreizend wirkt. Es bildet bei höherer Temperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 50 °C.[2] Der Explosionsbereich liegt zwischen 1,6 Vol.‑% (41 g/m3) als untere Explosionsgrenze (UEG) und 7,7 Vol.‑% (320 g/m3) als obere Explosionsgrenze (OEG).[2] Die Zündtemperatur beträgt 265 °C. Der Stoff fällt somit in die Temperaturklasse T3.[2]
Anwendungen
2-Ethylhexylamin reagiert mit 2-Chlornitrobenzol zu einem gelben Farbstoff (Automate Yellow 36), der zur Einfärbung von Kraftstoffen (englisch fuel marker) verwendet wird
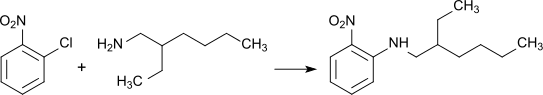
und bei dessen Herstellung es 1998 an einem Standort der Morton International Inc. in Paterson (New Jersey) zu einem im Nachgang intensiv untersuchten thermischen Durchgehen kam.[9]
Das Tetrafluorborsäure-Salz des 2-EHA ist als Additiv in Kraftstoffen gegen Vergaservereisung bei niedrigen Temperaturen beschrieben.[10]
Aminphosphat-Salze des 2-EHA mit Phosphorsäureestern verzweigter primärer C8–C16-Alkohole sind Treibstoffadditive zur Verringerung von Ablagerungen in Verbrennungsmotoren[11] und werden als Korrosionsinhibitoren für z. B. verzinnte Aerosoldosen eingesetzt.[12] ebenso wie Salze von 2-EHA mit N-Acylsarcosinaten.[13]
Zusammen mit Korrosionsinhibitoren wie Tolyltriazol findet 2-EHA Verwendung als Additiv zur Reibungs- und Verschleißverminderung in Treib- und Schmierstoffen.[14]
Sulfobernsteinsäure-Amide mit 2-EHA sind vielfältig anwendbare grenzflächenaktive Substanzen, die als Emulgatoren, Dispergiermittel, Schlichte für Textilien, Tenside, Flotationshilfsmittel usw. in Gebrauch sind.[15]
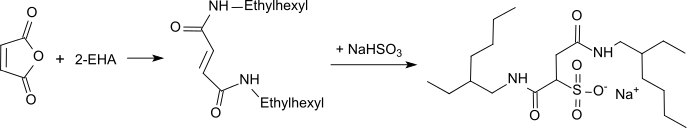
Bei der Umsetzung von 2-EHA mit Ethylencarbonat entsteht ein Urethan, das mit Ethylenoxid oder Propylenoxid zu geringschäumenden Tensiden und Netzmitteln alkoxyliert werden kann.[16]
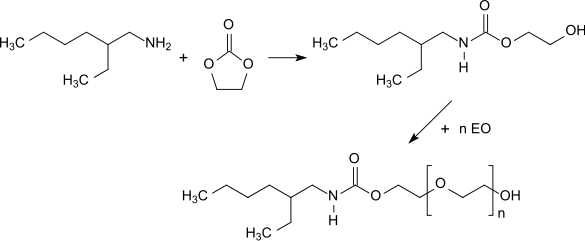
Die bei der Reaktion von 2-EHA mit 3-Chlorsulfonylpropionsäuremethylester und anschließende Hydrolyse entstehenden substituierten Propionsäuren eignen sich als wirksame Komponenten in Gemischen von Korrosionsinhibitoren mit antimikrobiellen Eigenschaften.[17]
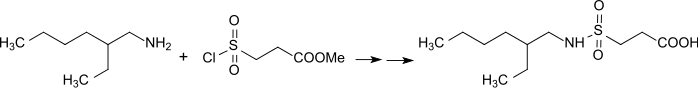
Nach einer allgemeinen Vorschrift von Walter Reppe reagiert auch das primäre Amin 2-Ethylhexylamin mit Acrylsäure im über zweimolaren Überschuss zum amphoteren Octyliminodipropionat,[18] das als gering schäumendes und pH-stabiles Hydrotrop (Lösungsvermittler) in industriellen Reinigern breitere Anwendung findet.[19][20]
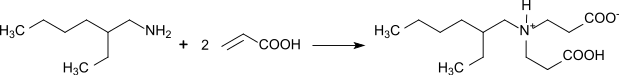
In Abhängigkeit vom pH-Wert liegt Octyliminodipropionat als elektrisch neutrales Zwitterion, im Sauren als kationisches Ammonium- und im Alkalischen als anionisches Carboxylat-Ion vor.
2-Ethylhexylamin findet als Härter bei der Vernetzung von Bisphenol-A-diglycidylether Verwendung.[21]
2-EHA reagiert mit Dodecenylbernsteinsäureanhydrid zum entsprechenden cyclischen Imid,
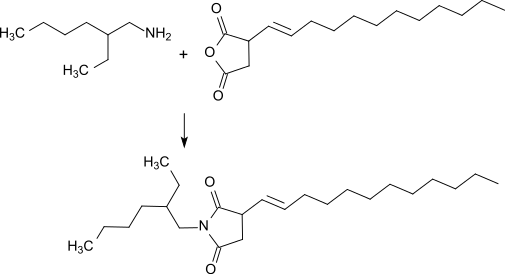
das als Zusatz zu Beschichtungssystemen zur kathodischen Elektrotauchlackierung (KTL) die Bildung von Löchern (engl. pinholes) in der Lackschicht unterdrückt.[22]
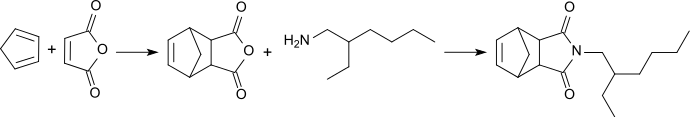
Aus 2-EHA und 5-Norbornen-2,3-dicarbonsäureanhydrid ist N-Octyl-bicyclohepten-dicarboximid zugänglich,[23] das als Synergist (Pyrodone) für Insektizide und als Repellent wirkt.
Die wichtigste pharmazeutische Verwendung von 2-Ethylhexylamin ist als Synthesebaustein für das Antiseptikum Hexetidin[24]
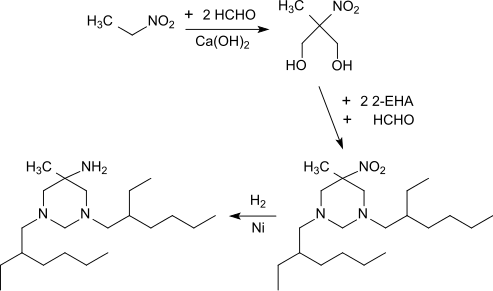
Die Synthese von Hexetidin folgt dem allgemeinen Verfahren von M. Senkus,[25] wobei in einer Mannich-Reaktion zwischen Nitroethan und Formaldehyd zunächst 2-Methyl-2-nitropropan-1,3-diol entsteht,[26] das mit zwei 2-EHA- und einem Formaldehydmolekül die Nitro-Vorstufe des Hexetidin bildet. Die Nitroverbindung wird mit Wasserstoff an Raney-Nickel zum Hexetidin hydriert.[27][28]
Das auf diesem Syntheseweg anfallende Hexetidin ist nur zu ca. 80 % rein, die Nebenprodukte können durch Salzbildung mit Naphthalin-1,5-disulfonsäure in heißen Alkohol-Wasser-Gemischen, wie z. B. Isopropanol oder Methanol praktisch quantitativ abgetrennt werden.[29]
Einzelnachweise
- Datenblatt 2-Ethyl-1-hexylamin bei Sigma-Aldrich, abgerufen am 25. Januar 2016 (PDF).
- Eintrag zu 2-Ethylhexylamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. August 2016. (JavaScript erforderlich)
- Oxea, Sicherheitsdatenblatt, 2-Ethylhexylamin
- Carl L. Yaws: The Yaws Handbook of Physical Properties of Hydrocarbons and Chemicals. 2. Auflage. Elsevier Inc., Amsterdam 2015, ISBN 978-0-12-800834-8, S. 224.
- M.A. Ayedi, Y. Le Bigot, H. Ammar, S. Abid, R. El Gharbi, M. Delmas: Synthesis of Primary Amines by One-Pot Reductive Amination of Aldehydes. In: Synth. Commun. Band 43, Nr. 16, 2013, S. 2127–2133, doi:10.1080/00397911.2012.714830.
- G.V. Sagar Reddy, G.V. Rao, R.V.K. Subramanyam, D.S. Iyengar: A New Novel and Practical One Pot Methodology for Conversion of Alcohols to Amines. In: Synth. Commun. Band 30, Nr. 12, 2000, S. 2233–2237, doi:10.1080/00397910008087402.
- Chemistry Archive, One pot conversion of alcohols to amines, https://www.erowid.org/archive/rhodium/chemistry/alcohol2amine.html
- Patent US3022349: Production of amines. Angemeldet am 30. Dezember 1957, veröffentlicht am 20. Februar 1962, Anmelder: Union Carbide Corp., Erfinder: R.C. Lemon, R.C. Myerly.
- US Chemical Safety and Hazard Investigation Board: Morton International Inc. Runaway Chemical Reaction (Memento vom 12. Mai 2016 im Internet Archive)
- Patent US3118745: Anti-stalling motor fuel. Angemeldet am 18. Januar 1961, veröffentlicht am 21. Januar 1964, Anmelder: Texaco Inc., Erfinder: E.C. Knowles, E.L. Kay, K.L. Dille.
- Patent US3909214: Multifunctional gasoline additive composition. Angemeldet am 27. Juli 1973, veröffentlicht am 30. September 1975, Anmelder: E.I. Du Pont de Nemours and Company, Erfinder: P. Polss.
- Patent US4604226: Aerosol corrosion inhibitors. Angemeldet am 22. März 1985, veröffentlicht am 5. August 1986, Anmelder: E.I. Du Pont de Nemours and Company, Erfinder: P.L. Bartlett.
- Patent US5032317: Process of inhibiting corrosion. Angemeldet am 18. September 1989, veröffentlicht am 16. Juli 1991, Anmelder: E.I. Du Pont de Nemours and Company, Erfinder: P.L. Bartlett.
- Patent US5482521: Friction modifiers and antiwear additives for fuels and lubricants. Angemeldet am 18. Mai 1994, veröffentlicht am 9. Januar 1996, Anmelder: Mobil Oil Corp., Erfinder: N.L. Avery, E.G. Barry, J.T. Carey, L.S. Crocker, F.W. Feng, J. Hiebert, A.G. Horodysky, L.A. Nelson.
- Patent US2192906: Diamides of aliphatic sulpho- and sulphato-dicarboxylic acids and processes of preparing them. Angemeldet am 17. September 1937, veröffentlicht am 12. März 1940, Anmelder: E.I. Du Pont de Nemours and Company, Erfinder: W.E. Hanford, C.O. Henke.
- Patent US8629297B2: Low-foaming surfactants. Angemeldet am 9. September 2010, veröffentlicht am 14. Januar 2014, Anmelder: Cognis IP Management GmbH, Erfinder: C. Münzenberg, H. Wiethoff.
- Patent EP0015442A1: Schaumarme Korrosionsinhibitoren mit antimikrobiellen Eigenschaften, die als wirksames Prinzip Borsäure-Alkanolamin-Umsetzungsprodukte enthalten. Angemeldet am 3. März 1979, veröffentlicht am 17. September 1980, Anmelder: BASF AG, Erfinder: K. Oppenlaender, E. Getto, W. Kindscher, A. Hettche.
- Patent US2195974: Process for producing new amino-carboxylic acids. Angemeldet am 10. Juli 1937, veröffentlicht am 2. April 1940, Anmelder: I.G. Farbenindustrie AG, Erfinder: W. Reppe, H. Ufer.
- Akzo Nobel, Ampholak YJH-40, http://sc.akzonobel.com/en/fabric-cleaning/Pages/product-detail.aspx?prodID=8204
- ict, FlexisurfTM EHDP, http://ictchemicals.com/media/1306/flexisurf-ehdp-technical-data-sheet.pdf
- M. Tarnacka, M. Wikarek, S. Pawlus, K. Kaminski, M. Paluch: Impact of high pressure on the progress of polymerization of DGEBA cured with different amine hardeners: dielectric and DSC studies. In: RSC Adv. Band 5, 2015, S. 105934–105942, doi:10.1039/C5RA19766J.
- Patent US7153406B2: Cathodic electrodeposition coating compositions and process for using same. Angemeldet am 15. Juli 2003, veröffentlicht am 26. Dezember 2006, Anmelder: E.I. Du Pont de Nemours and Company, Erfinder: H. Hoenig, E. Bambach, G. Pampoulidis, M. Valtrovic.
- Patent US2476512: N-2-Ethyl hexyl-α,α′-di-keto-β,β′-(1,4-Δ2-cyclopentenylene)-pyrrolidine and synthesis thereof. Angemeldet am 8. März 1947, veröffentlicht am 19. Juli 1949, Anmelder: Van Dyke & Co., Inc., Erfinder: A.A. Schreiber.
- A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances: Syntheses, Patents, Applications of the most relevant APIs. 5. Auflage. Thieme, Stuttgart 2009, ISBN 978-3-13-558405-8.
- M. Senkus: Reaction of primary aliphatic amines with formaldehyde and nitroparaffins. In: J. Am. Chem. Soc. Band 68, Nr. 1, 1946, S. 10–12, doi:10.1021/ja01205a004.
- B.M. Vanderbilt, H.B. Haas: Aldehyde-nitroparaffin condensation. In: Ind. Eng. Chem. Band 32, Nr. 1, 1940, S. 34–38, doi:10.1021/ie50361a007.
- M. Senkus: The Preparation of Some Hexahydropyrimidines from Nitroparaffins1. In: J. Am. Chem. Soc. Band 68, Nr. 8, 1946, S. 1611–1613, doi:10.1021/ja01212a073.
- Patent US2387043: 5-Aminohexahydropyrimidines and process for preparing same. Angemeldet am 29. Juli 1944, veröffentlicht am 16. Oktober 1945, Anmelder: Commercial Solvents Corp., Erfinder: M. Senkus.
- Patent US3749721: Process for the production of pure hexetidine. Angemeldet am 7. März 1970, veröffentlicht am 31. Juli 1973, Anmelder: Warner-Lambert Pharmaceutical Co., Erfinder: W. Herrmann, G. Satzinger.
Weblinks
- BASF: 2-Ethylhexylamin
- Eintrag zu 2-Ethylhexylamin. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD


