Phosphanliganden
Phosphanliganden sind Phosphane, also Verbindungen mit der Formel PRR'R" (R, R', R" = H, Alkyl, Aryl etc.), die als Liganden in Metallkomplexen und oft im Zusammenhang mit metallorganischer Chemie oder homogener Katalyse verwendet werden. Allerdings finden sie auch in anderen Bereichen der Chemie Verwendung.[1]
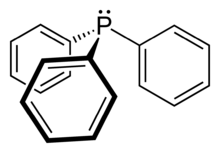
Gewöhnliche Phosphane
Die verbreitetsten Phosphanliganden entsprechen dem Typ PR3. Sie sind dreifach mit gleichen Resten substituiert. Einige der gebräuchlichsten von Ihnen sind Triphenylphosphan und Trimethylphosphin. Die Triarylphosphane sind für gewöhnlich stabile Feststoffe, wogegen die Trialkylphosphine Flüssigkeiten sind, die an Luft zu ihren korrespondierenden Phosphanoxiden (R3PO) reagieren. Derartige Liganden werden anhand ihrer Donorstärke und dem sterischen Anspruch klassifiziert. Eine Quantifizierung erfolgt dabei anhand des Tolman Electronic Parameters sowie des Tolman Kegelwinkels. Generell sind alkylphosphine stärkere Basen und σ-Donoren.
Mehrzähnige Phosphane
Zweizähnige Phosphane
Gebräuchliche bidentate, chelatisierende Phosphanliganden sind beispielsweise dppe and dmpe mit der Struktur R2PCH2CH2PR2 (R = Ph, Me).
Dreizähnige Phosphane
Es gibt zwei Arten von tridentaten Triphosphinen, linear und tripodal. Beide werden (verwirrenderweise) Triphos genannt. Die phenylsubstituierten Varianten haben die Formeln PhP(CH2CH2PPh2)2 (linear) und CH3C(CH2PPh2)3 (tripodal).
Vierzähnige Phosphane
Ein Beispiel für tetradentate tripodale Phosphanliganden ist Tris[2-(diphenylphosphino)ethyl]phosphan (pp3).[2]
Chirale Phosphane
Es existieren zwei Arten von chiralen Phosphanliganden, die beispielsweise in der asymmetrischen Katalyse wie der asymmetrischen Hydrogenierung eine Rolle spielen. Chirale Diphosphane sind dabei besonders Populär geworden. P-chirale Phosphane wie DIPAMP besitzen am Phosphor drei unterschiedliche Substituenten. BINAP ist hingegen ein Beispiel für C2-symmetrische Diphosphane, die aufgrund von Atropisomerie chirale Komplexe bilden.
| Eine Auswahl an Phosphanliganden | |||
| sPhos |  |
SPANphos | 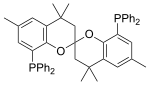 |
| SEGphos | 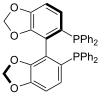 |
Triphos | |
| Xantphos | 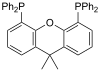 |
Kwon phosphin | 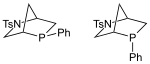 |
| Chiraphos | 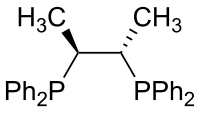 |
duPhos | 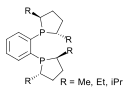 |
Verwendung
Haupteinsatzgebiet von Phosphanliganden sind eine Vielzahl an homogenen Katalysen, wie der Suzuki-Kupplung[3], der Buchwald-Hartwig-Kupplung[4][5], der Sonogashira-Kupplung[6][7] oder der Goldkatalyse.[8]
Einzelnachweise
- J.H. Downing, M.B. Smith: Phosphorus Ligands. In: Comprehensive Coordination Chemistry II. 2003, Januar, S. 253–296. doi:10.1016/B0-08-043748-6/01049-5.
- C. A. Ghilardi, S. Midollini, L. Sacconi: Reactions of the tripod ligand tris(2-diphenylphosphinoethyl)phosphine with cobalt(II) and nickel(II) salts and sodium borohydride. Structural characterization of a five-coordinate cobalt(I) hydride complex. In: Inorganic Chemistry. 14, Nr. 8, Mai 2002, S. 1790–1795. doi:10.1021/ic50150a010.
- Ruben Martin, Stephen L. Buchwald: Palladium-Catalyzed Suzuki−Miyaura Cross-Coupling Reactions Employing Dialkylbiaryl Phosphine Ligands. In: Accounts of Chemical Research. Band 41, Nr. 11, 18. November 2008, ISSN 0001-4842, S. 1461–1473, doi:10.1021/ar800036s, PMID 18620434, PMC 2645945 (freier Volltext).
- Frederic Paul, Joe Patt, John F. Hartwig: Palladium-catalyzed formation of carbon-nitrogen bonds. Reaction intermediates and catalyst improvements in the hetero cross-coupling of aryl halides and tin amides. In: Journal of the American Chemical Society. Band 116, Nr. 13, Juni 1994, ISSN 0002-7863, S. 5969–5970, doi:10.1021/ja00092a058.
- Anil S. Guram, Stephen L. Buchwald: Palladium-Catalyzed Aromatic Aminations with in situ Generated Aminostannanes. In: Journal of the American Chemical Society. Band 116, Nr. 17, August 1994, ISSN 0002-7863, S. 7901–7902, doi:10.1021/ja00096a059.
- A. G. Myers, P. S. Dragovich: Synthesis of functionalized Enynes by Palladium/Copper-Catalyzed Coupling Reactions of Acetylenes with (Z)-2,3-Dibromopropenoic Acid Ethyl Ester: (Z)-2-Bromo-5-(Trimethylsilyl)-2-Penten-4-Ynoic Acid Ethyl Ester In: Organic Syntheses. 72, 1995, S. 104, doi:10.15227/orgsyn.072.0104; Coll. Vol. 9, 1998, S. 117 (PDF).
- J. A. Marshall, C. A. Sehon: Isomerization of β-Alkynyl Allylic Alcohols to Furans Catalyzed by Silver Nitrate on Silica Gel: 2-Pentyl-3-Methyl-5-Heptylfuran In: Organic Syntheses. 76, 1999, S. 263, doi:10.15227/orgsyn.076.0263; Coll. Vol. 10, 2004, S. 599 (PDF).
- A. Stephen K. Hashmi: Gold-Catalyzed Organic Reactions. In: Chemical Reviews. Band 107, Nr. 7, Juli 2007, ISSN 0009-2665, S. 3180–3211, doi:10.1021/cr000436x.