Azomethin-Ylide
Azomethin-Ylide sind stickstoffhaltige 1,3-Dipole, welche aus einem Iminium und einem Carbanion bestehen. Sie werden in 1,3-dipolaren Cycloadditionen verwendet. So können Heterocyclen, wie Pyrrolidine oder Pyrroline aufgebaut werden.[1][2][3] Diese Reaktionen sind hoch stereo- und regioselektiv und besitzen das Potential vier zusammenhängende Stereozentren zu generieren. Azomethin-Ylide haben dadurch großen Nutzen in der Totalsynthese sowie der Herstellung von chiralen Liganden und Medikamenten. Azomethin-Ylide können aus verschiedenen Verbindungen, wie Aziridinen, Iminen und Iminium-Ionen hergestellt werden. Meist erfolgt die Herstellung in situ mit anschließender Reaktion mit einem Dipolarophil.
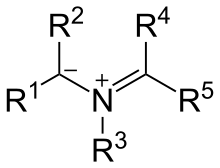
Struktur
Die Resonanzstruktur zeigt die 1,3-Dipol-Beiträge, in denen die an den Stickstoff gebundenen Kohlenstoffe eine Ladung tragen.[1] Die häufigste Darstellung von Azomethin-Yliden zeigt den Stickstoff mit einer positiven Ladung, die negative Ladung wird über die Kohlenstoffatome verteilt. Die tatsächliche Ladungsverteilung ist abhängig von den Substituenten an den jeweiligen Atomen. Kohlenstoffe mit elektronenziehenden Gruppen tragen auf Grund der Stabilisierung eine höhere negative Partialladung.
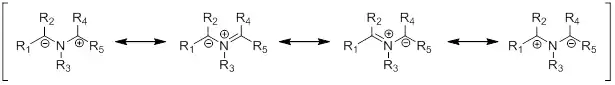
Azomethin-Ylide können in drei verschiedenen Formen (engl. shape) vorliegen, die die stereochemie der 1,3-dipolaren Cycloaddition bestimmen. Ylide können W-förmig (W-shaped), U-förmig (U-shaped) und S-förmig (S-shaped) sein.[1] Die W- und U-förmigen Ylide, in denen die Substituenten in die gleiche Richtung zeigen, führen zu syn-Produkten, während S-förmige Ylide zu anti-Produkten führen. Die Position des Substituenten R3 ist abhängig von sterischen und elektronischen Aspekten. Die Stereochemie von R1 und R2 im Produkt wird durch den Dipol bestimmt. Die Stereochemie von R3 resultiert aus der Art des Dipolarophils. Falls das Dipolarophil mehr als monosubstituiert und prochiral ist, können vier neue Stereozentren aufgebaut werden.
Herstellung
Aus Aziridinen
Azomethin-Ylide können durch Ringöffnung von Aziridinen generiert werden.[4][5] In Einklang mit den Woodward-Hoffmann-Regeln findet die thermische 4-Elektronen Ringöffnung in einem konrotatorischen Prozess statt, während die photochemische Reaktion disrotatorisch abläuft.

Für asymmetrische Aziridine ändert sich je nach Substituent die Torquoselektivität. Elektronegative Substituenten präferieren eine Rotation nach außen, während elektropositive Substituenten eher nach innen rotieren.[6]
Die Ringöffnung von Aziridinen kann neben dem Azomethin-Ylid auch einen anderen 1,3-Dipol liefern, wenn nicht die C-C-Bindung, sondern eine C-N-Bindung gebrochen wird.[7]
Durch Kondensation von Aldehyden mit Aminen
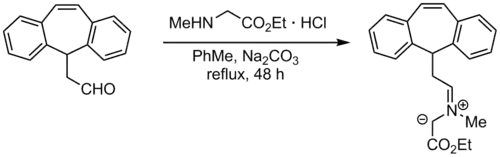
Eine der einfachsten Methoden Azomethin-Ylide zu generieren, besteht darin einen Aldehyd mit einem Amin einer Kondensation zu unterwerfen. Trägt das Amin am alpha-Kohlenstoff eine elektronenziehende Gruppe, wie einen Ester, kann einfach deprotoniert werden. Nachteil dieser Methode ist, dass sich die elektronenziehende Gruppe auch im Produkt der Cycloaddition wiederfindet. Alternativ zum Ester kann eine Carboxygruppe genutzt werden, die während der Cycloaddition durch Decarboxylierung entfernt werden kann.[8]
Aus Iminen und Iminium-Salzen

Azomethin-Ylide können durch direkte Deprotonierung von Iminium-Kationen gewonnen werden.
Durch N-Metallierung
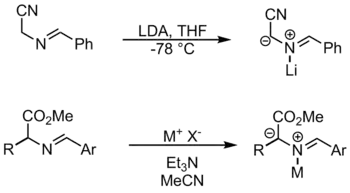
Bei dieser Methode koordiniert ein Metall am Stickstoff und aktiviert so das Substrat. Verwendet werden unter anderem LiBr und AgOAc.[1]
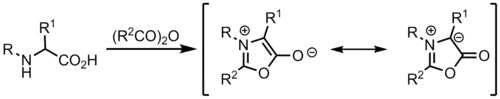
Münchnone
Münchnone sind mesoionische Heterocyclen, welche als Azomethin-Ylide fungieren können.[9]
1,3-Dipolare Cycloadditionen

Die 1,3-dipolare Cycloaddition mit Azomethin-Yliden ist ein 6-Elektronen Prozess. Gemäß der Woodward-Hoffmann-Regeln ist die Addition sowohl im Bezug auf den Dipol, als auch auf das Dipolarophil suprafacial. Die Reaktion wird generell als konzertiert angesehen, beide Kohlenstoff-Bindungen werden zur gleichen Zeit gebildet, jedoch asynchron. Je nach Natur des Dipols und des Dipolarophils sind aber auch diradikalische oder zwitterionische Intermediate möglich.[10] Wie auch in der isoelektronischen Diels-Alder-Reaktion ist das endo-Produkt favorisiert. In dieser Reaktion reagiert das HOMO des Ylides und das LUMO des elektronendefizitären Dipolarophils. Jedoch sind auch Reaktionen mit unaktivierten π-Systemen bekannt, vor allem, wenn es sich um eine intramolekulare Cyclisierung handelt.[11]

In 1,3-dipolaren Cycloadditionen von Azomethin-Yliden werden meist Alkene oder Alkine als Dipolarophil verwendet. Dabei entstehen Pyrrolidine oder Pyrroline.[12] Als Dipolarophil werden meist α,β-ungesättigte Carbonyle eingesetzt, andere funktionelle Gruppen sind Teil der aktuellen Forschung.[13]
Sind Dipol und Dipolarophil Teil des gleichen Moleküls, so kann die intramolekulare Reaktion zu Polycyclen mit hoher Komplexizität führen.[1] Ist das Dipolarophil mit einem Kohlenstoff des Dipols verknüpft, so entsteht ein annelierter Bicyclus. Ist das Dipolarophil an den Stickstoff gebunden, so entsteht eine überbrückte Struktur. Intramolekulare Varianten haben den Vorteil, dass die Regioselektivität häufig eingeschränkt ist. Ein weiterer Vorteil ist, dass bei intramolekularen Varianten das Dipolarophil nicht elektronenarm sein muss, es sind Varianten mit elektronenreichen, alkylsubstituierten Dipolarophilen bekannt.
Stereoselektivität der Cycloaddition
Während die meisten Dipole in Cycloadditionen ihre Stereoinformation verlieren, sind Azomethin-Ylide in der Lage ihr Stereochemie beizubehalten. Dies wird meist durch Öffnen eines Aziridins und anschließendes abfangen (trapping) durch ein Dipolarophil erreicht. So kann die Stereochemie das Ylides sich nicht ändern.
Wie in anderen 1,3-dipolaren Cycloadditionen können endo- und exo-Produkte entstehen. Die Selektivität kann durch Metallkatalyse verändert werden.[14][15]
Enantioselektive Synthese
Enantioselektive Cycloadditionen von Azomethin-Yliden durch die Verwendung von chiralen Katalysatoren wurden erstmals durch Allway und Grigg 1991 beschrieben.[16] Diese Methode wurde durch Jørgensen und Zhang weiterentwickelt. Diese Reaktionen verwenden Metallkomplexe von Zn, Ag, Cu, Ni und Ca.
Durch chirale Phosphin-Katalyse können enantiomerenreine Spiroindolinone synthetisiert werden. Die Methode, beschrieben von Gong et al. führt zu einer unerwarteten Regiochemie, die nicht durch elektronische Effekte bestimmt wird, sondern durch π-Stacking mit dem Katalysator.[17]
Weitere Reaktionen
Elektrocyclisierungen
Konjugiuerte Azomethin-Ylide können [1,5]- und [1,7]-Elektrocyclisierungen eingehen.[18] Ein Beispiel einer [1,7]-Elektrocyclisierung eines Diphenylethenyl-substituierten Azomehtin-Ylids ist abgebildet. Dem konrotatorischen Ringschluss folgt ein suprafacialer [1,5]-Hydridshift, wodurch das Produkt rearomatisiert. Die Sterik und Geometrie des Phenylring spielen eine entscheidende Rolle bei dieser Reaktion.[19]

Die Produkte dieser Reaktion werden in Diels-Alder-Reaktionen genutzt, um Fullerene zu modifizieren.[20]
In der Synthese
Totalsynthese von martinellic acid
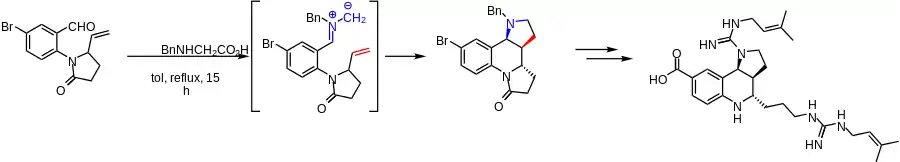
In dieser Synthese von martinellic acid (etwa martinellsche Säure) wird eine Cycloaddition mit einem unaktivierten Alken verwendet. In diesem Schlüsselschritt werden zwei Ringe aufgebaut, darunter ein Pyrrolidin, sowie zwei Stereozentren.[21]
Totalsynthese von Spirotryprostatin A
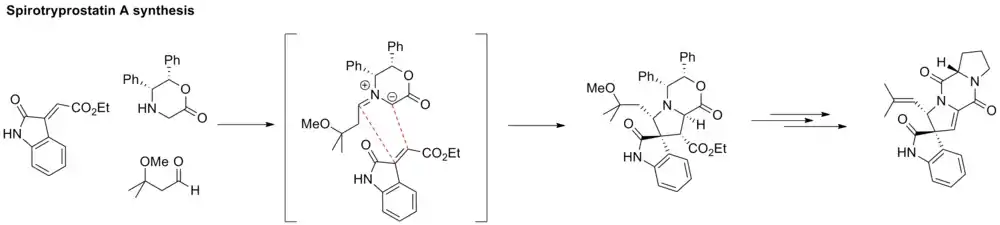
In der Synthese von Spirotryprostatin A wird ein Azomethin-Ylid durch die Kondensation eines Amins mit einem Aldehyd erhalten. Das Ylid reagiert mit einem elektronenarmen Alken, das an eine Indolinon gebunden ist. Es entsteht ein spiroanneliertes Pyrrolidin und vier zusammenhängende Stereozentren.[22]
Synthese von Benzodiazepinonen
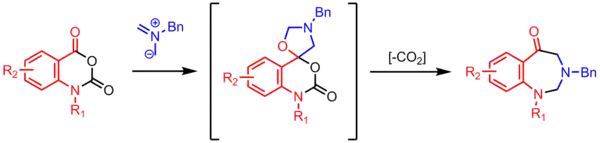
Cyclisierung eines Azomethin-Ylids mit einem Carbonyl resultiert in einem spiroannelierten Oxazolidin. Unter Abspaltung von CO2 bildet sich ein 7-gliedriger Ring.[23]
Einzelnachweise
- Iain Coldham, Richard Hufton: Intramolecular Dipolar Cycloaddition Reactions of Azomethine Ylides. In: Chemical Reviews. Band 105, Nr. 7, Juli 2005, S. 2765–2810, doi:10.1021/cr040004c.
- L. M. Harwood, R. J. Vickers: Azomethine Ylides: Azomethine Ylides. In: Chemistry of Heterocyclic Compounds: A Series Of Monographs. John Wiley & Sons, Inc., New York, USA 2003, ISBN 978-0-471-38726-8, S. 169–252, doi:10.1002/0471221902.ch3.
- Javier Adrio, Juan C. Carretero: Novel dipolarophiles and dipoles in the metal-catalyzed enantioselective 1,3-dipolar cycloaddition of azomethine ylides. In: Chemical Communications. Band 47, Nr. 24, 2011, S. 6784, doi:10.1039/c1cc10779h.
- Philippe Dauban, Guillaume Malik: A Masked 1,3-Dipole Revealed from Aziridines. In: Angewandte Chemie International Edition. Band 48, Nr. 48, 16. November 2009, S. 9026–9029, doi:10.1002/anie.200904941.
- Rolf Huisgen, Wolfgang Scheer, Helmut Huber: Stereospecific Conversion of cis-trans Isomeric Aziridines to Open-Chain Azomethine Ylides. In: Journal of the American Chemical Society. 89, Nr. 7, 1967, S. 1753–1755. doi:10.1021/ja00983a052.
- Harold D. Banks: Torquoselectivity Studies in the Generation of Azomethine Ylides from Substituted Aziridines. In: Journal of Organic Chemistry. 75, Nr. 8, 2010, S. 2510–2517. doi:10.1021/jo902600y. PMID 20329779.
- Ana L. Cardoso, Teresa M. V. D. Pinho e Melo: Aziridines in Formal [3+2] Cycloadditions: Synthesis of Five-Membered Heterocycles. In: European Journal of Organic Chemistry. 4. Juli 2012, S. n/a–n/a, doi:10.1002/ejoc.201200406.
- Edward Huie: Intramolecular [3 + 2] cycloaddition routes to carbon-bridged dibenzocycloheptanes and dibenzazepines. In: Journal of Organic Chemistry. 48, Nr. 18, 1983, S. 2994–2997. doi:10.1021/jo00166a011.
- Albert Padwa, Henry L. Gingrich, Richard Lim: Regiochemistry of intramolecular munchnone cycloadditions: preparative and mechanistic implications. In: The Journal of Organic Chemistry. Band 47, Nr. 12, Juni 1982, S. 2447–2456, doi:10.1021/jo00133a041.
- Kendall N. Houk, Javier Gonzalez, Yi Li: Pericyclic Reaction Transition States: Passions and Punctilios, 1935-1995. In: Accounts of Chemical Research. Band 28, Nr. 2, Februar 1995, S. 81–90, doi:10.1021/ar00050a004.
- Brad R. Henke, Andrew J. Kouklis, Clayton H. Heathcock: Intramolecular 1,3-dipolar cycloaddition of stabilized azomethine ylides to unactivated dipolarophiles. In: The Journal of Organic Chemistry. Band 57, Nr. 26, Dezember 1992, S. 7056–7066, doi:10.1021/jo00052a015.
- Chuo Chen, Xiaodong Li, Stuart L. Schreiber: Catalytic Asymmetric [3+2] Cycloaddition of Azomethine Ylides. Development of a Versatile Stepwise, Three-Component Reaction for Diversity-Oriented Synthesis. In: Journal of the American Chemical Society. Band 125, Nr. 34, August 2003, S. 10174–10175, doi:10.1021/ja036558z.
- Javier Adrio, Juan C. Carretero: Novel dipolarophiles and dipoles in the metal-catalyzed enantioselective 1,3-dipolar cycloaddition of azomethine ylides. In: Chemical Communications. Band 47, Nr. 24, 2011, S. 6784, doi:10.1039/c1cc10779h.
- Wenzhong Gao, Xumu Zhang, Malati Raghunath: Cu(I)-Catalyzed Highly Exo-selective and Enantioselective [3 + 2] Cycloaddition of Azomethine Ylides with Acrylates. In: Organic Letters. Band 7, Nr. 19, September 2005, S. 4241–4244, doi:10.1021/ol0516925.
- Ichiro Oura, Kenta Shimizu, Kenichi Ogata, Shin-ichi Fukuzawa: Highly Endo-Selective and Enantioselective 1,3-Dipolar Cycloaddition of Azomethine Ylide with α-Enones Catalyzed by a Silver(I)/ThioClickFerrophos Complex. In: Organic Letters. Band 12, Nr. 8, 16. April 2010, S. 1752–1755, doi:10.1021/ol100336q.
- Philip Allway, Ronald Grigg: Chiral Co(II) and Mn(II) catalysts for the 1,3-dipolar cycloaddition reactions of azomethine ylides derived from arylidene imines of glycine. In: Tetrahedron Letters. Band 32, Nr. 41, Oktober 1991, S. 5817–5820, doi:10.1016/S0040-4039(00)93563-9.
- Xiao-Hua Chen, Qiang Wei, Shi-Wei Luo, Han Xiao, Liu-Zhu Gong: Organocatalytic Synthesis of Spiro[pyrrolidin-3,3′-oxindoles] with High Enantiopurity and Structural Diversity. In: Journal of the American Chemical Society. Band 131, Nr. 38, 30. September 2009, S. 13819–13825, doi:10.1021/ja905302f.
- N. A. Nedolya, B. A. Trofimov: [1,7]-Electrocyclization reactions in the synthesis of azepine derivatives. In: Chemistry of Heterocyclic Compounds. Band 49, Nr. 1, April 2013, S. 152–176, doi:10.1007/s10593-013-1236-y.
- Judit Tóth, András Dancsó, Gábor Blaskó, László Tőke, Paul W. Groundwater: 1,7-Electrocyclization reactions of stabilized α,β:γ,δ-unsaturated azomethine ylides. In: Tetrahedron. Band 62, Nr. 24, Juni 2006, S. 5725–5735, doi:10.1016/j.tet.2006.03.088.
- Jean-François Eckert, Cyril Bourgogne, Jean-François Nierengarten: An unexpected Diels–Alder reaction on the fullerene core rather than an expected 1,3-dipolar cycloaddition. In: Chemical Communications. Nr. 7, 21. März 2002, S. 712–713, doi:10.1039/b201122k.
- Barry B. Snider, Yong Ahn, Sean M. O'Hare: Total Synthesis of (±)-Martinellic Acid. In: Organic Letters. Band 3, Nr. 26, Dezember 2001, S. 4217–4220, doi:10.1021/ol016884o.
- Tomoyuki Onishi, Paul R. Sebahar, Robert M. Williams: Concise, Asymmetric Total Synthesis of Spirotryprostatin A. In: Organic Letters. Band 5, Nr. 17, August 2003, S. 3135–3137, doi:10.1021/ol0351910.
- Nadia Spiccia, Jose Basutto, Pawel Jokisz, Leon S.-M. Wong, Adam G. Meyer: 1,3-Dipolar Cycloaddition-Decarboxylation Reactions of an Azomethine Ylide with Isatoic Anhydrides: Formation of Novel Benzodiazepinones. In: Organic Letters. Band 13, Nr. 3, 4. Februar 2011, S. 486–489, doi:10.1021/ol102824k.