Amino(ylid)substituierte Carbene
Amino(ylid)substituierte Carbene, auch als amino(ylid)stabilisierte Carbene bezeichnet, (AYCs) sind eine Gruppe von organischen Verbindungen. Sie zeichnen sich dadurch aus, dass das zentrale Carbenkohlenstoffatom mit einer Amin- und einer Ylid-Funktionalität substituiert ist. Im Gegensatz zu ihren schwereren Homologen in Form von amino(ylid)substituierten Silylenen[1] und Germylenen[2] konnten diese Verbindungen bisher zwar synthetisiert, aber nicht isoliert werden.

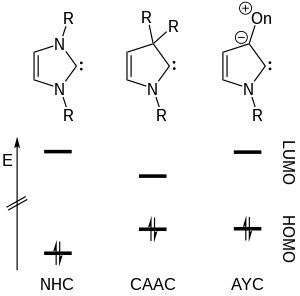
Struktur

N-Heterocyclische Carbene, eine aufgrund ihrer hohen Donorstärke vielfach als Liganden eingesetzte Verbindungen, werden dadurch stabilisiert, dass die freien Elektronenpaare der Stickstoffatome Elektronendichte zum Carbenzentrum donieren.[4] Allerdings führt die hohe Elektronegativität des Stickstoffs gleichzeitig dazu, dass diese durch einen starken -I-Effekt viel Elektronendichte vom Carbenzentrum ziehen und somit die σ-Donorstärke schwächen. Dieser Problematik kann entgangen werden, indem eines der Stickstoffatome durch ein weniger elektronegatives Element ausgetauscht wird. Dies ist beispielsweise mit Kohlenstoff in (Alkyl)(amino)carbenen (CAACs) der Fall. Diese weisen entsprechend eine höhere Energie des höchsten besetzten Molekülorbitals (HOMO) und somit bessere σ-Donoreigenschaften auf. Gleichzeitig führt allerdings das fehlende freie Elektronenpaar zu einer Destabilisierung des niedrigsten unbesetzten Molekülorbitals (LUMO) und somit zu besseren π-Akzeptoreigenschaften des Carbens.[3][5][6] Um die starken σ-Donoreigenschaften eines CAACs mit den schwachen π-Akzeptoreigenschaften eines NHCs zu kombinieren, bietet es sich an, das dem Carbenzentrum benachbarte alkylische Kohlenstoffatom in einem CAAC durch ein ylidisches Kohlenstoffatom zu substituieren. Ein solches besitzt dieselbe Elektronegativität und führt somit zu einem ähnlich schwachen -I-Effekt und damit verbunden zu einer hohen HOMO-Energie respektive guten σ-Donoreigenschaften.[3][5][6][7][8] Gleichzeitig besitzt es allerdings auch analog zu Aminogruppen ein freies Elektronenpaar und führt entsprechend zu einer hohen LUMO-Energie, also schlechten π-Akzeptoreigenschaften.[6][7][8]
Synthese
Die ersten AYCs wurden in den 1980er Jahren von Michelin und seinen Mitarbeitern durch Deptrotonierung von geeigneten Phosphoniumsalzen und anschließender Cyclisierung in der Koordinationssphäre von Platin synthetisiert.[9][10]
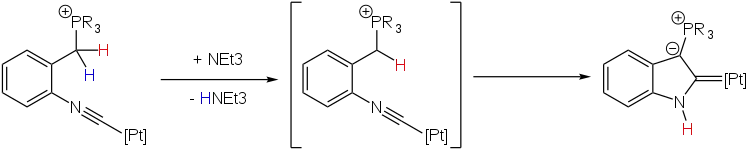
Eine ähnliche Syntheseroute konnten 2013 Alcarazo und seine Mitarbeiter zur Syntheseroute von acyclischen AYCs in der Koordinationssphäre von Gold vorstellen.[11]
Freie AYCs wurden bisher nicht isoliert. Zwar konnten diese erstmals im Jahr 2008 durch die Arbeitsgruppen von Bertrand,[12] Fürstner[13] und Kawashima[14][15] synthetisiert werden. Allerdings zersetzten sich diese bei höheren Temperaturen, wie zum Beispiel Raumtemperatur. In der Folge konnten sie bisher nur NMR-spektroskopisch in Lösung oder durch die Produkte von Abfangreaktionen nachgewiesen werden.[12][13][14][15] Die Synthese der AYCs erfolgte in diesen Fällen in der Regel durch Deprotonierung von geeigneten Pyrrol-,[12][15] Indol-[13][14][15] oder 4H-Pyrazol-Precursorverbindungen[13] in α-Position zum Stickstoff.

Eigenschaften und Reaktivität
Wie bereits besprochen, sind AYCs deutlich stärkere σ-Donoren als NHCs. Dies konnte beispielsweise durch Carbonylstreckschwingungen in Rhodium-Komplexen gezeigt werden.[13][14][15] Auch die 1JCH-Kopplungskonstante von Precursorverbindungen deutete auf eine zu CAACs vergleichbare σ-Donorstärke hin.[7] Computerchemische Rechnungen weisen in diesem Vergleich sogar auf bessere σ-Donoreigenschaften[5] und gleichzeitig schwächere π-Akzeptoreigenschaften hin.[6]
Durch Schwefel werden AYCs zu den korrespondierenden Sulfiden oxidiert.[13][14][15]
AYC-Palladiumkomplexe konnten weiterhin erfolgreich in der Buchwald-Hartwig-Aminierung eingesetzt werden.[14]
Einzelnachweise
- Isabel Alvarado-Beltran, Antoine Baceiredo, Nathalie Saffon-Merceron, Vicenç Branchadell, Tsuyoshi Kato: Cyclic Amino(Ylide) Silylene: A Stable Heterocyclic Silylene with Strongly Electron-Donating Character. In: Angewandte Chemie International Edition. Band 55, Nr. 52, 23. Dezember 2016, S. 16141–16144, doi:10.1002/anie.201609899.
- Juliette Berthe, Juan Manuel Garcia, Edgar Ocando, Tsuyoshi Kato, Nathalie Saffon-Merceron: Synthesis and Reactivity of a Phosphine-Stabilized Monogermanium Analogue of Alkynes. In: Journal of the American Chemical Society. Band 133, Nr. 40, 12. Oktober 2011, S. 15930–15933, doi:10.1021/ja2073577.
- Han Vinh Huynh: Electronic Properties of N-Heterocyclic Carbenes and Their Experimental Determination. In: Chemical Reviews. Band 118, Nr. 19, 10. Oktober 2018, S. 9457–9492, doi:10.1021/acs.chemrev.8b00067.
- Matthew N. Hopkinson, Christian Richter, Michael Schedler, Frank Glorius: An overview of N-heterocyclic carbenes. In: Nature. Band 510, Nr. 7506, Juni 2014, S. 485–496, doi:10.1038/nature13384.
- Bitupon Borthakur, Ashwini K. Phukan: Moving toward Ylide-Stabilized Carbenes. In: Chemistry - A European Journal. Band 21, Nr. 32, 3. August 2015, S. 11603–11609, doi:10.1002/chem.201500860.
- Diego M Andrada, Nicole Holzmann, Thomas Hamadi, Gernot Frenking: Direct estimate of the internal π-donation to the carbene centre within N-heterocyclic carbenes and related molecules. In: Beilstein Journal of Organic Chemistry. Band 11, 24. Dezember 2015, S. 2727–2736, doi:10.3762/bjoc.11.294, PMID 26877795, PMC 4734353 (freier Volltext).
- Henning Steinert, Christopher Schwarz, Alexander Kroll, Viktoria H. Gessner: Towards the Preparation of Stable Cyclic Amino(ylide)Carbenes. In: Molecules. Band 25, Nr. 4, 12. Februar 2020, S. 796, doi:10.3390/molecules25040796, PMID 32059503, PMC 7070660 (freier Volltext).
- Bibi Narjes Haerizade, Mohammad Zaman Kassaee, Hassan Zandi, Maryam Koohi, Ali A. Ahmadi: Ylide stabilized carbenes: a computational study: YLIDE STABILIZED CARBENES. In: Journal of Physical Organic Chemistry. Band 27, Nr. 11, November 2014, S. 902–908, doi:10.1002/poc.3353.
- Giacomo Facchin, Renzo Campostrini, Rino A. Michelin: Novel cyclic “ylide-carbene” complexes. In: Journal of Organometallic Chemistry. Band 294, Nr. 2, Oktober 1985, S. c21–c25, doi:10.1016/0022-328X(85)87478-7.
- Rino A. Michelin, Giacomo. Facchin, Dario. Braga, Piera. Sabatino: Functionalized isocyanides as ligands. 4. Base-promoted cyclization reactions of free and platinum(II)-coordinated o-(phosphoniomethyl)phenyl isocyanide tetrafluoroborates, o-(BF4-R3PCH2)C6H4NC. Synthesis and spectroscopic characterization of 1- and 2-platinum(II)-substituted indole derivatives and x-ray structure of [cyclic] trans-[(PPh3)2Pt[CN(H)-o-C6H4C(PMe3)]Cl]Bf4·C2H4Cl2. In: Organometallics. Band 5, Nr. 11, 1. November 1986, S. 2265–2274, doi:10.1021/om00142a016.
- Elisa González-Fernández, Jörg Rust, Manuel Alcarazo: Synthesis and Reactivity of Metal Complexes with Acyclic (Amino)(Ylide)Carbene Ligands. In: Angewandte Chemie International Edition. Band 52, Nr. 43, 18. Oktober 2013, S. 11392–11395, doi:10.1002/anie.201305311.
- Matthew Asay, Bruno Donnadieu, Antoine Baceiredo, Michele Soleilhavoup, Guy Bertrand: Cyclic (Amino)[bis(ylide)]carbene as an Anionic Bidentate Ligand for Transition-Metal Complexes. In: Inorganic Chemistry. Band 47, Nr. 10, 19. Mai 2008, S. 3949–3951, doi:10.1021/ic800459p, PMID 18422308, PMC 2574712 (freier Volltext).
- Alois Fürstner, Manuel Alcarazo, Karin Radkowski, Christian W. Lehmann: Carbenes Stabilized by Ylides: Pushing the Limits. In: Angewandte Chemie International Edition. Band 47, Nr. 43, 13. Oktober 2008, S. 8302–8306, doi:10.1002/anie.200803200.
- Shin-ya Nakafuji, Junji Kobayashi, Takayuki Kawashima: Generation and Coordinating Properties of a Carbene Bearing a Phosphorus Ylide: An Intensely Electron-Donating Ligand. In: Angewandte Chemie International Edition. Band 47, Nr. 6, 25. Januar 2008, S. 1141–1144, doi:10.1002/anie.200704746.
- Junji Kobayashi, Shin-ya Nakafuji, Atsushi Yatabe, Takayuki Kawashima: A novel ylide-stabilized carbene; formation and electron donating ability of an amino(sulfur-ylide)carbene. In: Chemical Communications. Nr. 46, 2008, S. 6233, doi:10.1039/b813454e.