Horner-Wadsworth-Emmons-Reaktion
Die Horner-Wadsworth-Emmons Reaktion (kurz: HWE-Reaktion, in manchen Lehrbüchern fälschlich als Wittig-Horner-Reaktion oder Horner-Wittig-Reaktion bezeichnet), ist eine Namensreaktion der Organischen Chemie, mit der stereoselektiv (E)- oder (Z)-Alkene hergestellt werden können. Dazu werden Aldehyde oder Ketone mit den Anionen von organischen Phosphonaten umgesetzt. Diese organischen Phosphonate werden häufig mithilfe einer Michaelis-Arbuzov-Reaktion gewonnen.[1] Im Gegensatz zur Wittig-Reaktion treten in der HWE-Reaktion keine Ylide auf, sondern phosphonatstabilisierte Carbanionen. Im folgenden Reaktionsschema wird als Beispiel ein Phosphonsäureester 1 mit einer Base deprotoniert, wobei ein phosphonatstabilisierten Carbanion entsteht. Dieses durch Mesomerie stabilisierte Carbanion ist kein Ylid. Durch Umsetzen mit einem Aldehyd (3) entsteht ein α,β-ungesättigten Carbonsäureethylester (4a). Als Nebenprodukt entsteht ein Dialkylphosphat (4b), welches durch wässrige Extraktion leicht abgetrennt werden kann.
_Reaktion.svg.png.webp)
1958 veröffentlichte Leopold Horner eine modifizierte Wittig-Reaktion (nach Georg Wittig) unter Verwendung phosphonatstabilisierter Carbanionen.[2][3] William S. Wadsworth, später Professor an der South Dakota State University, und William D. Emmons (1924–2001), beide damals Chemiker bei Rohm and Haas (Philadelphia), entwickelten diese Reaktion weiter.[4][5]
Im Gegensatz zu den Phosphoryliden der Wittig-Reaktion sind die phosphonatstabilisierten Carbanionen der HWE nucleophiler und weniger basisch. Die Dialkylphosphatsalze, die als Nebenprodukt anfallen, können einfach durch wässrige Extraktion entfernt werden. Zum Vergleich muss das bei der Wittig-Reaktion entstehende Triphenylphosphanoxid oftmals durch Umkristallisation oder Säulenchromatographie abgetrennt werden.[6][7]
Reaktionsmechanismus
Der Reaktionsmechanismus der Horner-Wadsworth-Emmons-Reaktion ist noch nicht genau bekannt. Sicher beginnt er mit der Deprotonierung des Phosphonats, es bildet sich das Phosphonatcarbanion 1. Man vermutet weiterhin, dass die nucleophile Addition des Carbanions an den Aldehyd 2 (oder auch Keton), die zum Zwischenprodukt 3a oder 3b führt, als der geschwindigkeitsbestimmende Schritt gilt.[8] Wenn R2 = H ist, können sich die Intermediate 3a und 4a und die Intermediate 3b und 4b ineinander umwandeln.[9] Eine Eliminierung des Dialkylphosphat aus Oxaphosphetanen 4a und 4b ergibt das (E)-Alken 5 und das (Z)-Alken 6.
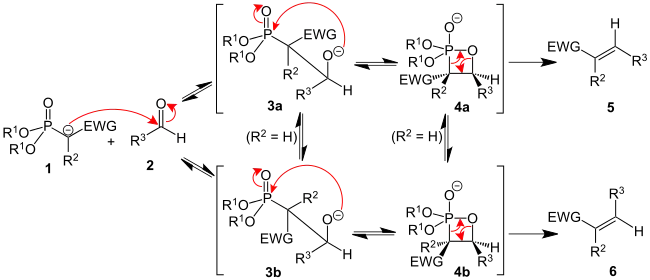
Das Verhältnis der diastereomeren Alkene 5 und 6 ist nicht abhängig vom stereochemischen Ausgang der Carbanionadditon, sondern hängt weitgehend vom Ausmaß des chemischen Gleichgewichts zwischen den Intermediaten (3a, 3b, 4a und 4b) ab.
Die elektronenziehende Gruppe (kurz: EWG – electron withdrawing group) in α-Position zum Phosphonat ist für die Reaktion unbedingt erforderlich. In Abwesenheit einer „EWG“ ist das Endprodukt der Reaktion das α-H-Hydroxyphosphonat 3a bzw. 3b.[10] Diese α-H-Hydroxyphosphonate können mit Diisopropylcarbodiimid in Alkene umgewandelt werden.[11]
Stereoselektivität
Die HWE-Reaktion bevorzugt die Bildung von (E)-Alkenen. Generell gilt, je besser sich das Gleichgewicht zwischen den Intermediaten einstellen kann, desto höher die Selektivität bzw. der (E)-Alkenanteil.
Disubstituierte Alkene
S. K. Thompson und Clayton H. Heathcock veröffentlichten eine systematische Studie der Reaktion von Trimethylphosphonoacetat mit verschiedenen Aldehyden.[12] Während die einzelnen Unterschiede klein waren, zeigte sich ein kumulativer Effekt, der es ermöglicht die Stereoselektivität mit Hilfe der Struktur des Phosphonats zu steuern. Folgende Bedingungen erhöhen die E-Stereoselektivität:
- Ansteigende sterische Hinderung am Aldehyd
- Höhere Reaktionstemperaturen
- Bei Salzen: Li > Na > K
- Lösungsmittel DME statt THF
In einer weiteren Studie konnte gezeigt werden, dass sterisch anspruchsvolle Phosphonate und „EWGs“ die (E)-Alkenselektivität ebenfalls erhöhen.
Trisubstituierte Alkene
Der sterische Anspruch der Phosphonate und der EWGs zeigt tatsächlich einen Effekt auf die Reaktion von α-verzweigten Phosphonaten mit aliphatischen Aldehyden.[13]
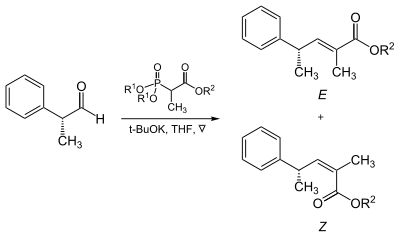
| R1 | R2 | Anteile der Alkene (E : Z) |
|---|---|---|
| Methyl | Methyl | 5 : 95 |
| Methyl | Ethyl | 10 : 90 |
| Ethyl | Ethyl | 40 : 60 |
| Isopropyl | Ethyl | 90 : 10 |
| Isopropyl | Isopropyl | 95 : 5 |
Aromatische Aldehyde ergeben meist ausschließlich (E)-Alkene. Will man (Z)-Alkene aus aromatischen Aldehyden darstellen, ist die Still-Gennari-Variante (siehe unten) eine Möglichkeit.
Olefinierung von Ketonen
Die Stereoselektivität der HWE ist hier gering bis durchschnittlich.
Variationen
Basen-empfindliche Substrate
Da viele Substrate empfindlich auf Natriumhydrid reagieren, wurde einige Studien zu milderen Basen durchgeführt. Zum einen „Masamune und Roush“ mit Lithiumchlorid und DBU[14] und „Rathke“ mit Lithium oder Magnesiumhalogenen mit Triethylamin[15] und andere Basen.[16][17][18]
Still-Gennari-Variante
Still und Gennari entwickelten Bedingungen, die eine Reaktion mit sehr hoher Stereoselektivität zu (Z)-Alkenen ermöglichen.[19] Man nutzt Phosphonate mit elektronenziehenden Gruppen (z. B.: Trifluorethyl[20]) zusammen mit stark dissoziierenden Bedingungen (KHMDS und [18]-Krone-6 in THF).
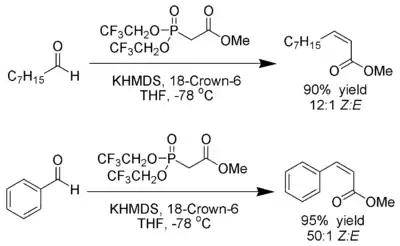
Ando hat hierzu postuliert, dass der Gebrauch elektronenarmer Phosphonate die Eliminierung der Oxophosphonate beschleunigt.[21]
Siehe auch
- Michaelis-Arbuzov-Reaktion zur Gewinnung der Phosphonate für die HWE-Reaktion
- Peterson-Olefinierung
- Tebbe-Methylenierung
- Wittig-Reaktion
- Michaelis-Becker-Reaktion
Literatur
- William S. Wadsworth: Synthetic Applications of Phosphoryl-Stabilized Anions. In: Organic Reactions. 25, Nr. 2, 1977, S. 73–253, doi:10.1002/0471264180.or025.02.
- John Boutagy, Richard Thomas: Olefin synthesis with organic phosphonate carbanions. In: Chemical Reviews. 74, Nr. 1, 1974, S. 87–99, doi:10.1021/cr60287a005.
- Sarah E. Kelly: Alkene Synthesis. In: Ian Fleming, Barry M. Trost (Hrsg.): Comprehensive Organic Synthesis. Volume 1: Additions to C-X π-Bonds, Part 1, Pergamon, Oxford 1991, ISBN 0-08-040592-4, S. 729–817.
- Bruce E. Maryanoff, Allen B. Reitz: The Wittig olefination reaction and modifications involving phosphoryl-stabilized carbanions. Stereochemistry, mechanism, and selected synthetic aspects. In: Chemical Reviews. 89, Nr. 4, 1989, S. 863–927, doi:10.1021/cr00094a007.
Einzelnachweise
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage. Springer Spektrum, ISBN 978-3-662-45684-2, S. 470.
- Leopold Horner, Hellmut Hoffmann, Hans G. Wippel: Phosphororganische Verbindungen, XIII. Darstellung von Phosphinsäuren aus Phosphinoxyden. In: Chemische Berichte. 91, Nr. 1, 1958, S. 64–67, doi:10.1002/cber.19580910114.
- Leopold Horner, Hellmut Hoffmann, Hans G. Wippel, Günther Klahre: Phosphororganische Verbindungen, XX. Phosphinoxyde als Olefinierungsreagenzien. In: Chemische Berichte. 92, Nr. 10, 1959, S. 2499–2505, doi:10.1002/cber.19590921017.
- William S. Wadsworth, William D. Emmons: The Utility of Phosphonate Carbanions in Olefin Synthesis. In: Journal of the American Chemical Society. 83, Nr. 7, 1961, S. 1733–1738, doi:10.1021/ja01468a042 (Science Citation Classics, pdf).
- W. S. Wadsworth, Jr., W. D. Emmons: Ethyl Cyclohexylideneacetate In: Organic Syntheses. 45, 1965, S. 44, doi:10.15227/orgsyn.045.0044; Coll. Vol. 5, 1973, S. 547 (PDF).
- Theodor Wieland, Ludwig Gattermann, Wolfgang Sucrow: Die Praxis des organischen Chemikers. 43. Auflage. Walter de Gruyter & Co, 1983, S. 456.
- Klaus Schwetlick: Organikum. 24. Auflage. Wiley-VCH, Weinheim, ISBN 978-3-527-33968-6, S. 553.
- Rolf Olaf Larsen, Gunnar Aksnes: Kinetic Study of the Horner-Reaction. I. In: Phosphorus and Sulfur and the Related Elements. Band 15, Nr. 2, April 1983, S. 219–228, doi:10.1080/03086648308073297.
- Gerard Lefèbvre, Jacqueline Seyden-Penne: The mechanism of the Horner–Emmons modification of the Wittig reaction. In: Journal of the Chemical Society D: Chemical Communications., Nr. 20, 1970, S. 1308–1309, doi:10.1039/C29700001308.
- E. J. Corey, George T. Kwiatkowski: The Synthesis of Olefins from O,O’-Dialkyl β-Lithioalkylphosphonothioate Esters. In: Journal of the American Chemical Society. 88, Nr. 23, 1966, S. 5654–5656, doi:10.1021/ja00975a057.
- John F. Reichwein, Brian L. Pagenkopf: A New Horner−Wadsworth−Emmons Type Coupling Reaction between Nonstabilized β-Hydroxy Phosphonates and Aldehydes or Ketones. In: Journal of the American Chemical Society. 125, Nr. 7, 2003, S. 1821–1824, doi:10.1021/ja027658s.
- Scott K. Thompson, Clayton H. Heathcock: Effect of cation, temperature, and solvent on the stereoselectivity of the Horner-Emmons reaction of trimethyl phosphonoacetate with aldehydes. In: The Journal of Organic Chemistry. 55, Nr. 10, 1990, S. 3386–3388, doi:10.1021/jo00297a076.
- Hiroto Nagaoka, Yoshito Kishi: Further synthetic studies on rifamycin s. In: Tetrahedron. 37, Nr. 23, 1981, S. 3873–3888, doi:10.1016/S0040-4020(01)93261-2.
- Mary A. Blanchette, William Choy, Jeffery T. Davis, Amy P. Essenfeld, Satoru Masamune, William R. Roush, Toshiya Sakai: Horner-wadsworth-emmons reaction: Use of lithium chloride and an amine for base-sensitive compounds. In: Tetrahedron Letters. 25, Nr. 21, 1984, S. 2183–2186, doi:10.1016/S0040-4039(01)80205-7.
- Michael W. Rathke, Michael Nowak: The Horner-Wadsworth-Emmons modification of the Wittig reaction using triethylamine and lithium or magnesium salts. In: The Journal of Organic Chemistry. 50, Nr. 15, 1985, S. 2624–2626, doi:10.1021/jo00215a004.
- Ian Paterson, Kap-Sun Yeung, Jeff B. Smaill: The Horner-Wadsworth-Emmons Reaction in Natural Products Synthesis: Expedient Construction of Complex (E)-Enones Using Barium Hydroxide. In: Synlett. 1993, Nr. 10, 1993, S. 774–776, doi:10.1055/s-1993-22605.
- Daniele Simoni, Marcello Rossi, Riccardo Rondanin, Angelica Mazzali, Riccardo Baruchello, Cinzia Malagutti, Marinella Roberti, Francesco Paolo Invidiata: Strong Bicyclic Guanidine Base-Promoted Wittig and Horner−Wadsworth−Emmons Reactions. In: Organic Letters. 2, Nr. 24, 2000, S. 3765–3768, doi:10.1021/ol0001665.
- Landy K. Blasdel, Andrew G. Myers: Use of Lithium Hexafluoroisopropoxide as a Mild Base for Horner−Wadsworth−Emmons Olefination of Epimerizable Aldehydes. In: Organic Letters. 7, Nr. 19, 2005, S. 4281–4283, doi:10.1021/ol051785m.
- W. Clark Still, Cesare Gennari: Direct synthesis of Z-unsaturated esters. A useful modification of the horner-emmons olefination. In: Tetrahedron Letters. 24, Nr. 41, 1983, S. 4405–4408, doi:10.1016/S0040-4039(00)85909-2.
- C. Patois, P. Savignac, E. About-Jaudet, N. Collignon,: Bis(Trifluoroethyl) (Carboethoxymethyl)phosphonate In: Organic Syntheses. 73, 1996, S. 152, doi:10.15227/orgsyn.073.0152; Coll. Vol. 9, 1998, S. 88 (PDF).
- Kaori Ando: Highly Selective Synthesis of Z-Unsaturated Esters by Using New Horner−Emmons Reagents, Ethyl (Diarylphosphono)acetates. In: The Journal of Organic Chemistry. 62, Nr. 7, 1997, S. 1934–1939, doi:10.1021/jo970057c.
- Kaori Ando, Tohru Oishi, Masahiro Hirama, Hiroaki Ohno, Toshiro Ibuka: Z-Selective Horner−Wadsworth−Emmons Reaction of Ethyl (Diarylphosphono)acetates Using Sodium Iodide and DBU. In: American Chemical Society (Hrsg.): J. Org. Chem. 2000, 65, 15, 4745–4749. 2000, doi:10.1021/jo000068x.
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage. Springer Spektrum, ISBN 978-3-662-45684-2, S. 472.
- Kaori Ando, Kenji Narumiya, Hirokazu Takada, Taiji Teruya: Z-Selective Intramolecular Horner-Wadsworth-Emmons Reaction for the Synthesis of Macrocyclic Lactones. In: American Chemical Society (Hrsg.): Org. Lett., Vol. 12, No. 7, 2010. 2010, doi:10.1021/ol100071d.
_olefination_reaction.svg.png.webp)