Tetrahydrofuran-2,5-dimethanol
Tetrahydrofuran-2,5-dimethanol ist ein heterocyclisches Diol, bei dem der fünfgliedrige Oxolanring in Nachbarschaft zum Sauerstoffatom (in 2- und 5-Stellung) jeweils eine Hydroxymethylgruppe trägt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
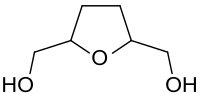 | ||||||||||||||||
| Vereinfachte Strukturformel cis-Form und trans-Formen | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetrahydrofuran-2,5-dimethanol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H12O3 | |||||||||||||||
| Kurzbeschreibung |
klare farblose[1] ölige Flüssigkeit | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 132,16 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt |
< −50 °C[2] | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck |
30 Pa (105 °C)[3] | |||||||||||||||
| Löslichkeit |
vollständig mischbar mit Wasser, Ethanol, Aceton, Benzol,[2] Pyridin,[4] DMSO[5] und Acetonitril[6] | |||||||||||||||
| Brechungsindex |
1,4766 (25 °C, 589 nm)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Die katalytische Hydrierung von Hydroxymethylfurfural, einer wichtigen Plattformchemikalie aus nachwachsenden Rohstoffen, liefert unter geeigneten Bedingungen überwiegend das cis-Isomere (meso-Bis(hydroxymethyl)tetrahydrofuran).[4]
THF-Diol findet als biobasierter Rohstoff für Kraftstoffe,[8] PVC-Weichmacher[9] oder als Molekülbaustein (engl. building block) für Wirkstoffe sowie für „grüne“ Monomere wie z. B. 1,6-Hexandiol, Hexamethylendiamin oder Caprolactam[10] zunehmendes Interesse.
Darstellung
Die Synthese von 2,5-Bis(hydroxymethyl)tetrahydrofuran durch Hydrierung von Hydroxymethylfurfural in Gegenwart von Raney-Nickel in „exzellenten Ausbeuten“ wurde bereits 1945 beschrieben[11] und das Produkt als cis-Isomeres (= meso-Form) identifiziert.[4]
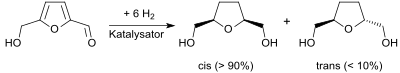
Wegen der Durchführung in Diethylether bei 160 °C und 14 MPa Druck für 20 Stunden eignet sich der Prozess nicht für größere Ansätze. Die Suche nach milderen Reaktionsbedingungen bei hoher Selektivität für THF-diol ist in mehreren Patenten[12] und Publikationen[6][10] beschrieben. Inzwischen konnten bei der Hydrierung mit Nickel/Palladium-Katalysatoren bei 40 °C und 8 MPa Wasserstoffdruck nach 2 Stunden Ausbeuten von 96 % erzielt werden.[13] Bei längeren Reaktionszeiten, höheren Temperaturen und saurem pH-Werten muss mit der Spaltung des Furanrings und der Bildung von C6-Polyolen gerechnet werden.[14] Das gefundene cis-trans-Verhältnis liegt bei 90:10[5] bis 98:2.[10]
Auch kontinuierliche ein- oder zweistufige Verfahren zur Darstellung von Tetrahydrofuran-2,5-dimethanol werden diskutiert.[15] Dabei wird auch auf die nur teilweise reversible Desaktivierung des Nickel-Katalysators hingewiesen.
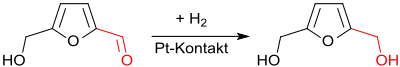
Unter schonenderen Bedingungen, z. B. bei 35 °C und 0,8 MPa Wasserstoffdruck an einem Platin-Kontakt in wässrigem Medium, wird nur die Aldehydgruppe des Hydroxymethylfurfurals hydriert und praktisch quantitativ 2,5-Bis(hydroxymethyl)furan erhalten.[16]
Die Herstellung von THF-diol durch Hydrierung von Tetrahydrofuran-2,5-dicarbonsäuredimethylester (durch Veresterung von 2,5-Furandicarbonsäure mit Methanol und anschließende Hydrierung in Gegenwart von Raney-Nickel) an einem Kupferchromit-Kontakt bzw. mit Lithiumaluminiumhydrid ist ebenfalls beschrieben, aber unergiebig.[4]
Eigenschaften
Tetrahydrofuran-2,5-dimethanol ist eine klare, ölige, farblose bis hellgelbe Flüssigkeit, die mit Wasser und vielen organischen Lösungsmitteln vollständig mischbar ist. Die Verbindung ist hygroskopisch und in einem Temperaturbereich von über 300 °C flüssig.
Anwendungen
Tetrahydrofuran-2,5-dimethanol als Lösungsmittel
THF-diol ist ein aprotisch dipolares Lösungsmittel und kann Ethylenglycol und Propylenglycol in Latexfarben ersetzen.[17] Emissionen flüchtiger organischer Verbindungen (VOC) werden dabei deutlich reduziert.
Tetrahydrofuran-2,5-dimethanol als Ausgangsstoff für funktionelle Moleküle
Mit der von Arthur C. Cope zuerst beschriebenen Synthese pharmakologisch aktiver heterocyclischer Tropan-Analoga aus THF-Diol über das Di-tosylat[4][6] wurde die praktisch ausschließlich vorliegende cis-Konfiguration des Diols bestätigt.
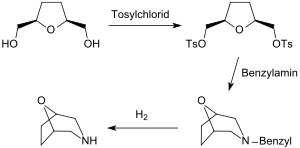
Die beiden Hydroxymethylgruppen des THF-diols können in Disulfonate und diese mit Natriumcyanid in Dinitrile überführt werden. Aus dem Dinitril Tetrahydrofuran-2,5-diacetonitril sind durch partielle Hydrierung, z. B. mit DIBAL der Dialdehyd, durch Hydrolyse die Dicarbonsäure und durch vollständige Hydrierung das Diamin zugänglich.[18]
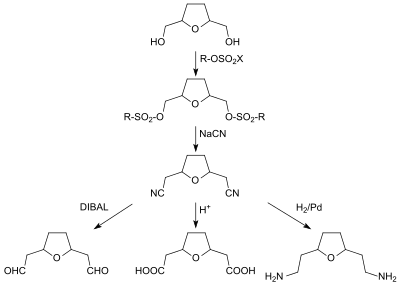
Intensiv bearbeitet werden in neuerer Zeit Hydrierungs- und Hydrogenolyse-Reaktionen an Tetrahydrofuran-2,5-dimethanol, die abhängig von den Reaktionsbedingungen unterschiedliche Produkte erzeugen.
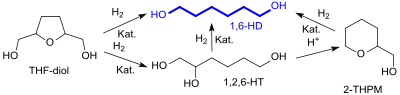
Neben dem direkten Weg führt die Hydrierung alternativ über 1,2,6-Hexantriol (1,2,6-HT) und 2-Tetrahydropyranmethanol (2-THPM) ebenfalls zu 1,6-Hexandiol (1,6-HD).
Tetrahydrofuran-2,5-dimethanol als Monomer für Polyester
Durch Umesterung von 2,5-Bis(hydroxymethyl)tetrahydrofuran mit Dimethylterephthalat in Gegenwart des Umesterungskatalysators Titantetrabutanolat entstehen in einer Polykondensationsreaktion Polyester.[1]
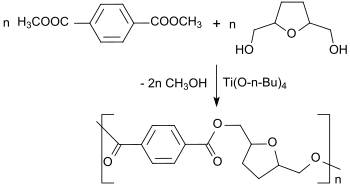
Die erhaltenen Polyester sind amorph oder semi-kristallin und thermoplastisch verarbeitbar, so dass sie interessante Ähnlichkeiten zu Polyethylenterephthalat aufweisen.
THF-diol als Molekülbaustein aus erneuerbaren Ressourcen hat bisher zwar einige vornehmlich wissenschaftliche Aufmerksamkeit, aber noch keine industrielle Anwendung gefunden. Am aussichtsreichsten erscheint derzeit eine zukünftige Verwendung als biobasierte Rohstoffquelle für 1,6-Hexandiol, einer möglichen Vorstufe für die Polyamidmonomeren 1,6-Diaminohexan (für Polyamid 6.6) und Caprolactam (für Polyamid 6) zu sein.
Als Folge der künftigen großvolumigen und dann preisgünstigen Verfügbarkeit der Plattformchemikalie Hydroxymethylfurfural (HMF) könnte sein Hydrierprodukt Tetrahydrofuran-2,5-dimethanol als Schlüsselverbindung für biobasierte Monomere für Polyester, Polyamide und eventuell auch für Polyurethane erheblich an Bedeutung gewinnen.
Literatur
- F. Cavani, S. Albonetti, F. Basile, A. Gandini (Hrsg.): Chemicals and Fuels from Bio-Based Building Blocks, Volume 1. Wiley-VCH, Weinheim 2016, ISBN 978-3-527-33897-9.
- I. Delidovich, P.J.C. Hausoul, L. Deng, R. Pfützenreuther, M. Rose, R. Palkovits: Alternative monomers based on lignocellulose and their use of polymer production. In: Chem. Rev. Band 116, Nr. 3, 2016, S. 1540–1599, doi:10.1021/acs.chemrev.5b00354.
- Z. Fang, R.L. Smith, Jr., X. Qi (Hrsg.): Production of Platform Chemicals from Sustainable Resources. Springer Nature Singapore Pte. Ltd., Singapore 2017, ISBN 978-981-10-4171-6.
- I.T. Horváth, M. Malacria (Hrsg.): Advanced Green Chemistry, Part 1: Greener Organic Reactions and Processes. World Scientific Publishing Co. Pte. Ltd., Singapore 2018, ISBN 978-981-3228-10-8.
Einzelnachweise
- Patent WO2016102361A1: Polyesters from aromatic carboxylic diacid and 2,5-Bis(hydromethyl)tetrahydrofuran. Angemeldet am 18. Dezember 2015, veröffentlicht am 30. Juni 2016, Anmelder: Rhodia Operations, Erfinder: S. Jeol.
- William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2015, ISBN 978-1-4987-5428-6, S. 3–26.
- Eintrag zu 2,5-Bis(hydroxymethyl)tetrahydrofuran in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Januar 2018. (JavaScript erforderlich)
- A.C. Cope, W.N. Baxter: Aminoalcohols Containing the 8-Oxa-3-azabicyclo [3.2.1]octane Ring System and Their Benzoates. In: J. Am. Chem. Soc. Band 77, Nr. 2, 1955, S. 393–396, doi:10.1021/ja01607a049.
- Patent WO2013188252A2: Diallyl ethers of 2,5-bis(hydroxymethyl)tetrahydrofuran and processes for making the same. Angemeldet am 12. Juni 2013, veröffentlicht am 19. Dezember 2013, Anmelder: Archer Daniels Midland Co., Erfinder: K. Stensrud.
- T.J. Connolly et al.: Efficient synthesis of 8-Oxa-3-aza-bicyclo[3.2.1]octane Hydrochloride. In: Org. Process Res. Dev. Band 14, 2010, S. 459–465, doi:10.1021/op9002642.
- Eintrag zu Tetrahydrofuran-2,5-diyldimethanol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 28. Januar 2018. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Patent WO2009141166A1: Fuel composition. Angemeldet am 19. Mai 2008, veröffentlicht am 26. November 2009, Anmelder: Furanix Technologies B.V., Erfinder: G.J.M. Gruter, E. De Jong.
- Patent WO2015032794A1: Tetrahydrofuranderivate und deren Verwendung als Weichmacher. Angemeldet am 4. September 2013, veröffentlicht am 12. März 2015, Anmelder: BASF SE, Erfinder: J. Wagner, B. Breitscheidel, M.A. Bohn, B. Blank, A. Kindler.
- T. Buntara, S. Noel, P.H. Phua, J. Melián-Cabrera, J.G. de Vries, H.J. Heeres: Caprolactam from renewable resources: Catalytic conversion of 5-hydroxymethylfurfural into caprolactone. In: Angew. Chem. Int. Ed. Band 50, Nr. 31, 2011, S. 7083–7087, doi:10.1002/anie.201102156.
- W.N. Haworth, W.G.M. Jones, L.F. Wiggins: 1. The conversion of sucrose into furan compounds. Part II. Some 2:5-disubstituted tetrahydrofurans and their products of ring scission. In: J. Chem. Soc. Band 0, 1945, S. 1–4, doi:10.1039/JR9450000001.
- Patent US3040062: Process for preparing 2,5-bis hydroxymethyl tetrahydrofuran. Angemeldet am 14. November 1960, veröffentlicht am 19. Juni 1962, Anmelder: Atlas Chemical Industries, Inc., Erfinder: R.A. Hales.
- Y. Nakagawa, K. Tomishige: Total hydrogenation of furan derivatives over silica-supported Ni-Pd alloy catalyst. In: Catal. Commun. Band 12, 2010, S. 154–156, doi:10.1016/j.catcom.2010.09.003.
- R. Alamillo, M. Tucker, M. Chia, Y. Pagán-Torres, J. Dumesic: The selective hydrogenation of biomass-derived 5-hydroxymethylfurfural using heterogeneous catalysts. In: Green Chem. Band 14, Nr. 5, 2010, S. 1413–1419, doi:10.1039/C2GC35039D.
- S. Lima, D. Chadwick, K. Hellgardt: Towards sustainable hydrogenation of 5-(hydroxymethyl)furfural: a two-stage continuous process in aqueous media over RANEYR catalysts. In: RSC Advances. Band 7, 2017, S. 31401–31407, doi:10.1039/C7RA03318A.
- M. Chatterjee, T. Ishizaka, H. Kawanami: Selective hydrogenation of 5-hydroxymethylfurfural to 2,5-bis-(hydroxymethyl)furan using Pt/MCM-41 in an aqueous medium: a simple approach. In: Green Chem. Band 16, Nr. 11, 2014, S. 4734–4739, doi:10.1039/C4GC01127A.
- Patent US7579490B2: Conversion of 2,5-(hydroxymethyl)furaldehyde to industrial derivatives, purification of the derivatives, and industrial uses therefor. Angemeldet am 15. November 2005, veröffentlicht am 25. August 2009, Anmelder: Archer-Daniels-Midland Company, Erfinder: A.J. Sanborn, P.D. Bloom.
- Patent US20160207894A1: Synthesis of diacids, dialdehydes, or diamines from THF-diols. Angemeldet am 25. September 2014, veröffentlicht am 21. Juli 2016, Anmelder: Archer Daniels Midland Company, Erfinder: K. Stensrud.
