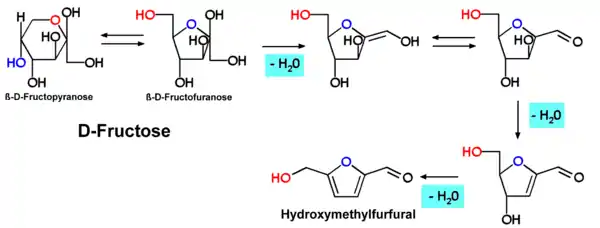
Hydroxymethylfurfural
Hydroxymethylfurfural, HMF oder 5-(Hydroxymethyl)furfural, auch 5-Oxymethylfurfurol, ist eine Aldehyd- und Furanverbindung, die sich bei der nicht-enzymatischen, thermischen Zersetzung von Zucker oder Kohlenhydraten bildet und dient daher als Indikator für die Erhitzung von Lebensmitteln. HMF kann in vielen mit Hitze behandelten Lebensmitteln einschließlich Milch, Fruchtsaft, alkoholischen Getränken, Honig usw. nachgewiesen werden. Aktuelle Studien prüfen den Nachweis von HMF in Zigaretten. HMF kann zur Modifizierung bei der Kunststoffherstellung eingesetzt werden. Hexosen, insbesondere Fructose, bilden durch eine mehrfache (säurekatalysierte) Dehydratisierung das HMF.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
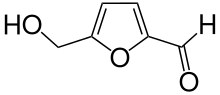 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Hydroxymethylfurfural | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C6H6O3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 126,11 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,21 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Das Bundesinstitut für Risikobewertung bemerkte, dass 5-HMF-Gehalte in Lebensmitteln „nach derzeitigem wissenschaftlichen Kenntnisstand gesundheitlich unproblematisch“ wären.[3] Die Hauptaufnahme erfolge über den Genuss von Kaffee.
Geschichte
Diese organische Verbindung wurde 1895 erstmals von G. Düll durch die Dehydratisierung von Fructose bzw. Saccharose mit Oxalsäure und unabhängig davon durch J. Kiermeyer hergestellt.[4][5] Des Weiteren beobachtete der französischen Chemiker Louis Maillard 1912 im Rahmen seiner Forschungsarbeit über nicht enzymatische Reaktionen von Glucose und Lysin dessen Bildung bei der nach ihm benannten Maillard-Reaktion.[6][7]
Die Maillard-Reaktion ist eine chemische Reaktion zwischen Aminosäuren und reduzierenden Zuckern, die gebräunten Lebensmitteln ihren unverwechselbaren Geschmack verleiht. Die Reaktion ist eine Form der nicht-enzymatischen Bräunung, die typischerweise schnell von etwa 140 bis 165 °C (280 bis 330 °F) fortschreitet. Bei höheren Temperaturen werden die Karamellisierung (Bräunung von Zucker, ein ausgeprägter Prozess) und anschließend die Pyrolyse (endgültiger Abbau, der zur Verbrennung führt) ausgeprägter. Eines der Endprodukte der Maillard-Reaktion ist 5-Hydroxymethylfurfural (5-HMF).[6]
Wenn Fructose erhitzt wird, bildet sich aus Fruchtzucker HMF.
Vorkommen
HMF in Honig
Um (bei Lagerung teilkristallisierten) Honig fließfähiger zu machen und ihn schneller oder mit höherem Ertrag aus den Bienenwaben ausschleudern oder auspressen zu können werden die Waben oder nur der Honig erhitzt. Durch (Über)Erhitzung werden aber die am Honig geschätzten Naturstoffe (Proteine, Enzyme, Aminosäuren, Vitamine, Farb- und Aromastoffe und Pollen) „deaktiviert“, vermindert oder gänzlich zerstört, wodurch die (von den Konsumenten erwartete) Honigqualität leidet. Durch Karamellisierung bei partieller Übererhitzung können Aromastoffe entstehen, die teuren Waldhonig vortäuschen können und dadurch Honigfälschungen[8] geschmacklich aufwerten helfen. Falscher (meist mit billigem Reissirup gestreckter) Honig überschwemmt den Weltmarkt „im ganz großen Maßstab“.[8] In der EU ist Honig auf Platz 6 der gefälschten Lebensmittel, 1,4 von zehn Honigproben seien laut EU-Analyse verfälscht.[8]
Ein hoher HMF-Wert des Honigs weist auf länger anhaltende Erwärmung oder Lagerung hin. Der HMF-Gehalt in frisch geschleudertem Honig ist sehr gering und steigt bei korrekter Lagerung, je nach pH-Wert und Lagertemperatur um ca. 2–3 mg/kg pro Jahr an. Lagerung bei Zimmertemperatur (21 °C) kann den HMF-Gehalt in einem Jahr bereits auf 20 mg/kg erhöhen. Die EU hat einen HMF-Grenzwert von maximal 40 mg/kg für Honig, der unter europäischen Bedingungen produziert wurde, festgelegt. Einige nationale Imkerverbände fordern sogar noch niedrigere Werte, z. B. erlaubt der Deutsche Imkerbund höchstens 15 mg/kg für sein Gütesiegel „Echter Deutscher Honig“.
HMF-Gehalte sonstiger Lebensmittel
Tabelle 1: 5-HMF Gehalte verschiedener Lebensmittel in mg/kg bei ausreichend großen Messungen[3]
| Lebensmittel | Gehalt in mg/kg (Mittelwert) |
| Traubensaft | 6,3 |
| Apfelsaft | 7,4 |
| Honig | 9,1 |
| Müsliriegel | 36,3 |
| Roggenmischbrot | 44,5 |
| Gebrannte Mandeln (dragiert) | 155,5 |
| Löslicher Kaffee (Pulverform) | 286,1 |
| Trockenpflaumen | 350,8 |
| Pflaumenmus | 410,9 |
| Getränk aus Trockenpflaumen | 1022,1 |
Herstellung, Synthese und Nachweis
Die Bildung von Hydroxymethylfurfural wurde unter anderem im Verlauf einer Karamellisierung von Hexosen (z. B. Fructose, Maltose, Glucose) beobachtet. Der Bildungsmechanismus entspricht dem bei Pentosen zu Furfural führenden Schema.
Auch polymere Zucker wie Stärke oder Cellulose zeigen diese Reaktion. Es ist bekannt, dass sich Hexosen durch die Lobry-de-Bruyn-Alberda-van-Ekenstein-Umlagerung ineinander umwandeln können. Beim Rösten von Zichorienwurzel zur Herstellung von Ersatzkaffee wird Inulin teilweise zu Hydroxymethylfurfural umgewandelt, das für das kaffeeähnliche Aroma sorgt.[9]
In einer einstufigen Synthese kann Cellulose in Gegenwart von gekoppelten Kupfer(II)-chlorid/Chrom(II)-chlorid-Katalysatoren in der ionischen Flüssigkeit 1-Ethyl-3-methylimidazoliumchlorid als Lösungsmittel bei 80–120 °C zu 5-Hydroxymethylfurfural (HMF) umgesetzt werden.[10][11] Unter diesen Bedingungen verläuft die Synthese etwa zehnmal schneller als bei einer herkömmlichen säurekatalysierten Hydrolyse.
HMF wird meistens mittels Hochleistungsflüssigkeitschromatographie oder photometrisch mit dem sogenannten Winkler-Verfahren[12] nachgewiesen. Seit 2009 ist ein Schnelltest von der Merck KGaA zur Bestimmung von HMF (in Honig) erhältlich. Bei dem „Reflectoquant® HMF“ genannten Test wird eine geringe Menge Honig im Verhältnis 1:4 mit destilliertem Wasser verdünnt, ein Teststreifen in die Probe getaucht und dann in einem RQflex-Reflektometer gemessen.
Verwendung
5-Hydroxymethylfurfural in der Chirurgie
Präoperative Mikronährstoffergänzungen in Fast-Track-Chirurgieprogrammen haben gezeigt, dass sie Komplikationen reduzieren, die Regeneration verkürzen und damit die Kosten senken. Die metabolischen Effekte einer Kombination aus α-Ketoglutarsäure (AKG) und 5-Hydroxymethylfurfural (5-HMF) hatten Auswirkungen auf die Verbesserung der Leistungsfähigkeit und den Abbau von oxidativem Stress in der Lungenchirurgie.[13]
Physiologische Bedeutung
Mögliche Karzinogenität
Das amerikanische National Institute of Environmental Health Sciences gibt für HMF ein hohes Risiko, dass es krebserregend sein könnte, an. Grund dafür ist, dass andere Mitglieder dieser Gruppe von Verbindungen krebserregende Eigenschaften zeigen. Untersuchungen über die Schädlichkeit von HMF selbst sind bisher jedoch nur in geringem Umfang durchgeführt worden.
In Untersuchungen diverser Substanzen im Hinblick auf krebsvorbeugende Eigenschaften konnte für 5-HMF keine solche Wirkung nachgewiesen werden.[14][15]
Die mögliche Fehlinterpretation der kanzerogenen Eigenschaft soll darauf beruhen, dass 5-HMF erst seit einigen Jahren als Reinsubstanz (>99 %) isoliert werden kann. Reinstes 5-HMF ist ein farbloses Pulver.
Sicherheit und Toxizität
Das Bundesinstitut für Risikobewertung bemerkte, dass 5-HMF-Gehalte in Lebensmitteln „nach derzeitigem wissenschaftlichen Kenntnisstand gesundheitlich unproblematisch“ wären.[3] Die Hauptaufnahme erfolge über den Genuss von Kaffee.
Zahlreiche, aber divergierende Studien wurden im Hinblick auf ein mögliches genotoxisches oder krebserregendes Potenzial von HMF durchgeführt. Unterschiede in den Ergebnissen können auf unterschiedliche angewandte Konzentrationen von HMF in Studien zurückgeführt werden, die zum Teil extrem hoch und weit entfernt von den realen Bedingungen waren. Basierend darauf wurde jedoch ein Schwellenwert von 540 μg/Person/Tag, wie auch im Capuano-Review angegeben,[16] 2005 von der EFSA empfohlen.[17] Dieser Wert ist unrealistisch, da die geschätzte HMF-Aufnahme 4-30 mg/Person/Tag beträgt und manchmal bis zu 350 mg betragen kann, womit 2011 das Deutsche Institut für Risikobewertung, das BfR, zu folgender Einschätzung kam: „5-HMF-Gehalte in Lebensmitteln sind nach derzeitigem wissenschaftlichen Kenntnisstand gesundheitlich unproblematisch“.[3] 5-HMF kommt in hohen Mengen auch in bestimmten Lebensmitteln vor u. a. in Trockenfrüchte 25-2900 mg/kg, Karamellprodukte 110-9500 mg/kg oder Kaffee (instant) 400-4100 mg/kg vor. Eine sehr umfangreiche und detaillierte Studie über die krebserregende Aktivität von HMF ist im NTP-Bericht[18] beschrieben, wo sie zu dem Schluss kommt, dass es unter den Bedingungen dieser 26-jährigen Gavage-Studien keine Hinweise auf eine krebserregende Aktivität von 5-HMF bei Ratten gab (188-375 mg/kg). Daraus schloss das BfR, dass die tierexperimentell abgeleitete höchste Dosis ohne unerwünschte Wirkungen im Bereich zwischen 80 und 100 mg/kg Körpergewicht liege.[3] Bei einem durchschnittlichen Körpergewicht von 70 kg bedeutet das 5600-7000 mg.
Pharmakokinetik und Metabolismus
Frühere pharmakokinetische Studien wurden von Ulbricht[19] und Czok[20] überprüft, die eine Dosis von 100 mg HMF/kg Körpergewicht an Ratten und Mäusen oral oder intravenös verabreichten. Oral-verabreichtes HMF verschwand schnell aus dem Verdauungstrakt und es wurden nur Spurenmengen im Blutplasma und Urin nachgewiesen. Das deutet darauf hin, dass HMF schnell metabolisiert wird. Intravenös injiziertes HMF konnte nach kurzer Zeit nicht mehr im Blutplasma nachgewiesen werden, während im Urin und in der Galle nur geringe Mengen nachgewiesen wurden. Ähnliche Beobachtungen wurden von Germond[21] gemacht. Wenn einzelne orale Gavage-Dosen von 5 HMF bei 0,08 bis 330 mg/kg oral oder intravenös verabreicht wurden, wurde weniger als 1 % der Radioaktivität in den Körperhöhlenorganen und im Stuhl zurückgehalten. 85 % der Radioaktivität wurden nach 8 Stunden und 95 - 100 % der Radioaktivität nach 24 Stunden eliminiert. Als Metaboliten wurden 5-Hydroxymethyl-2-furosäure (HMFA) und N-(5-Hydroxymethyl-2-furoyl) Glycin durch NMR und MS identifiziert. Jellum[22] fand beim Menschen heraus, dass etwa 50 % über den Urin als HMFA und Furan-2,5-Dicarbonsäure (FDCA) ausgeschieden wurden, nachdem man parenterales HMF mit Fructoselösungen erhalten hatte. Es wurden keine unveränderten HMF und keine Glycin-Konjugate im Urin gefunden. Godfrey[23] verabreichte HMF oral an Mäuse und Ratten in Dosierungen von 5 - 500 mg/kg. 60-80 % der verabreichten Dosen wurden innerhalb von 48 Stunden über den Urin ausgeschieden. Als Metaboliten wurden HMFA, FDCA und N-(5-Hydroxymethyl-2-furoyl)glycin identifiziert. Jüngste pharmakokinetische Studien wurden von Monien durchgeführt.[24] Die Autoren bestätigten, dass HMF schnell ausgeschieden wird und im Urin nach kurzer Zeit nicht mehr nachgewiesen werden kann. In einer Studie mit 6 gesunden menschlichen Probanden identifizierte Prior[25] 5-Hydroxymethyl-2-furosäure, 5-Carbonsäure-2-furoyl-glycin, N-5-Hydroxymethyl-2-furoyl-glycin und 5-Carbonsäure-3-furoyl-aminomethan als Metaboliten durch HPLC-MS/MS nach Verbrauch von 3944 μmol (497 mg) oder 486 μmol (61,2 mg) 5-HMF, die in Pflaumensaft bzw. getrockneten Pflaumen enthalten sind. Die geschätzte Gesamtrückgewinnung der Metaboliten betrug 46,2 % bzw. 14,2 % der 5-HMF-Dosis während der ersten 6 Stunden nach dem Verzehr. 5-Sulfomethylfurfural (5-SMF), möglicherweise durch Sulfokonjugation[24][25][26] gebildet, das als mutagen und krebserregend nachgewiesen/bestimmt wurde, wurde in den oben genannten Berichten mit Ausnahme einer aktuellen Studie von Monien[24] nicht als Metabolit beobachtet. Die Autoren zeigten, dass SMF in HMF-behandelten Mäusen gebildet wird. Für die Analyse wurde LC-MS/MS verwendet. SMF wurde jedoch nicht als Metabolit beim Menschen gefunden.
Allgemeiner Mechanismus von 5-Hydroxymethylfurfural
Die Hauptaufgabe von 5-HMF ist es, Ammoniak/Amine kovalent zu eliminieren. Es reagiert mit reaktiven Stickstoffspezies (RNS), wie Peroxynitrit, und bindet freie Radikale in seinem stabilen Resonanzsystem. 5-HMF erhöht effektiv einen speziellen Singulett-Sauerstofftransport, Sättigung, Aufnahme und Energieproduktion in den Zellen. Es entfernt den durch den Abbau von Aminosäuren freigesetzten Stickstoff (Ausgleich der körpereigenen Stickstoffchemie und Vermeidung einer Stickstoffüberlastung). Außerdem setzt 5-HMF die Peroxidproduktion in der inneren mitochondrialen Membran in der Nähe des Ubichinon-Komplexes zu H2O, CO2 und der oxidativen Form Succinat um. Des Weiteren ist 5-HMF eine sehr wirksame, nicht-enzymatisch kontrollierte Entgiftungssubstanz von Ammoniak, die Azomethinderivate bildet und direkt durch Harnstoff entfernt wird (z. B. Transport von Ammoniak aus dem Gehirn).
Mode of Action – intrazellulär
Vier Arten von freien Radikalen wurden ausgewählt, um die Fangleistung von 5-HMF zu beurteilen, darunter der stickstoffabgeleitete Rest DPPH, sauerstoffabgeleitete Hydroxyl- und Superoxid-Anionenreste und kohlenstoffabgeleitete Alkylreste. 5-HMF hatte die stärkste fangende Aktivität am Hydroxylrest bei IC50 22.8 μM, verglichen mit dem relativ schwachen Alkylrest bei IC50 45,0 μM. 5-HMF zeigte eine signifikante Potenz (p<0,05) beim Abfangen von Hydroxylradikalen in verschiedenen Konzentrationen, mit Abfrageanteilen von 92 % (100 μM), 62 % (25 μM), 30 % (10 μM) und 7 % (1 μM). Der IC50-Wert von 5-HMF wurde mit 22,8 μM berechnet. In Bezug auf die Struktur von 5-HMF enthält es einige interessante funktionelle reaktive Gruppen wie Doppelbindungen, ein Aldehyd-Sauerstoffatom und einen weiteren im Furanring vorhandenen Sauerstoff, der Elektronen leicht anziehen kann; außerdem kann eine Hydroxygruppe auch nach der Abgabe eines Wasserstoffions einen Singulett-Sauerstoff bilden. Diese Merkmale sollten die Hauptfaktoren für seine antioxidative Aktivität sein, indem sie übermäßig produzierende freie Radikale im Körper abfangen und die Aktivität des Oxidationsenzyms (MPO) verringern oder die Fähigkeit der antioxidativen Enzyme Glutathion (GSH) und Superoxiddismutase (SOD) auf Genebene erhöhen.[27] Die folgenden Eigenschaften von 5-HMF wurden systematisch ausgewertet: seine antioxidativen Aktivitäten; Membranproteinoxidation; oxidative Enzymmyeloperoxidase (MPO)-Hemmung; sowie Expressionen von selenhaltigen antioxidativen Enzymen Glutathion (GSH) und Superoxiddismutase (SOD) auf Genebene. Die antioxidative Aktivität von 5-HMF wird durch direktes Abfangen von zellulärem ROS verursacht, und deshalb kann 5-HMF als potenter Antioxidanskandidat zur Hemmung der zellulären ROS-Bildung entwickelt werden. Jüngste Ergebnisse belegen die hemmende Wirkung von 5 HMF auf die Nitrierung von Tyrosinen durch Peroxynitrit.[28]
Mode of Action – intra- und extrazellulär
Durch die Struktur von 5-HMF ist es nicht nur ein besonders stabiles Pseudoaroma, sondern verfügt durch seine Carbonylgruppe über ein durchkonjugiertes Resonanzsystem. So kann 5-HMF in seinem umfangreichen Resonanzsystem, das langlebige Radikale bildet, radikale Elektronen (z. B. Peroxynitrit) stabil halten. Ein weiterer positiver Effekt ist die Eliminierung von ONOO- (Peroxynitrit), einem stark oxidierenden und desaminierenden Mittel für Nukleotide und von OH*-Radikalen (nach Abbau von Peroxynitrit), das Membranen gesunder Zellen zerstört. 5-HMF wurde als ein neu gefundener Wirkstoff identifiziert, der die Chinon-Reduktase (QR) induziert. Dies ist ein bekanntes Entgiftungsenzym der Phase II.[29]
Vergleich 5-HMF vs. Vitamine
Antioxidantien wie Vitamin C und E reagieren mit allen freien Radikalen, d. h. auch in situ „essentielle“ Radikale (Immunabwehr), was zu vielen Dysfunktionen führt. 5-HMF eliminiert überwiegend hochreaktive Stickstoffarten (RNS) (z. B. Peroxide), nicht aber die „Essentiellen“. In ihrer Funktion, freie Radikale zu entfernen, wenden sie sich an hochpotenzielle Substanzen (z. B. Vitamin C Radikal). Diese Stoffe können auch unkontrollierte Funktionsstörungen verursachen (z. B. NOS-Dysfunktion).
Einzelnachweise
- Datenblatt Hydroxymethylfurfural bei AlfaAesar, abgerufen am 14. März 2010 (PDF) (JavaScript erforderlich).
- Datenblatt 5-(Hydroxymethyl)-furan-2-carbaldehyd (PDF) bei Merck, abgerufen am 4. April 2011.
- Stellungnahme Nr. 030/2011: 5-HMF-Gehalte in Lebensmitteln sind nach derzeitigem wissenschaftlichen Kenntnisstand gesundheitlich unproblematisch. BfR, 15. Mai 2011, abgerufen am 30. Oktober 2019.
- G. Düll: Über die Einwirkung von Oxalsäure auf Inulin. In: Chemiker-Zeitung. Band 19, Nr. 116, 1895, S. 216–217.
- Jaroslaw Lewkowski: Synthesis, Chemistry and Applications of 5-Hydroxymethyl-furfural and Its Derivatives. In: ChemInform. 34, 2003, doi:10.1002/chin.200302269.
- Maillard et al.: Action des acides amines sur les sucres; formation de melanoidines par voie méthodique [Action of amino acids on sugars. Formation of melanoidins in a methodical way]. Comptes Rendus (in French). 154: 66–68.
- Catherine Billaud, Jean Adrian: Louis‐Camille Maillard, 1878–1936. In: Food Reviews International. Band 19, Nr. 4, S. 345–374, doi:10.1081/fri-120025480.
- Thomas Trescher: Gepanscht und verfälscht: Der große Honigschwindel; kurier.at
- Ben-Erik van Wyck: Food Plants of the World Timber Press, 2006, ISBN 0-88192-743-0. S. 134.
- Y. Su, H. M. Brown, X. Huang, X. Zhou, J. E. Amonette, Z. C. Zhang: Single-step conversion of cellulose to 5-hydroxymethylfurfural (HMF), a versatile platform chemical. In: Appl. Catalysis. A 361, 2009, S. 117–122. doi:10.1016/j.apcata.2009.04.002.
- Zusammenfassung in: Chem. Ing. Techn. 81, 2009, S. 679.
- DIN 10751-1:2010-08: Untersuchung von Honig – Bestimmung des Gehaltes an Hydroxymethylfurfural – Teil 1: Photometrisches Verfahren nach Winkler.
- Matzi et al.: The impact of preoperative micronutrient supplementation in lung surgery. A prospective randomized trial of oral supplementation of combined a-ketoglutaric acid and 5-hydroxymethylfurfural, Eur J CardThorac Surg, 32 (2007): 776–782.
- H. Xiao, K. L. Parkin: Isolation and identification of potential cancer chemopreventive agents from methanolic extracts of green onion (Allium cepa). In: Phytochemistry. 68, Nr. 7, 2007, S. 1059–1067.
- H. Xiao, K. L. Parkin: Induction of phase II enzyme activity by various selenium compounds. In: Nutrition and Cancer. 55. Nr. 2, 2006, S. 210–223. doi:10.1207/s15327914nc5502_13.
- Capuano, Fogliano et al.: Acrylamide and 5-Hydroxymethylfurfural (HMF): A review on metabolism, toxicity, occurrence in food and mitigation strategies, LWT – Food Science and Technology 44, (2011), 793–810.
- Flavouring Group Evaluation 66 (FGE.66)1: Consideration of furfuryl alcohol and related flavouring substances evaluated by JECFA (55th meeting) structurally related to Furfuryl and furan derivatives with and without additional side chain substituents and heteroatoms evaluated by EFSA in FGE.13 (2005) (EFSA-Q-2008-032R), The EFSA Journal (2009) ON-752, 1–39.
- NTP technical report on the toxicology and carcinogenesis studies of 5-HMF (CAS NO. 67-47-0) in F344/N rats and B6C3F1 mice (Gavage studies), National institutes of Health public health service U.S. Department of health and human services (2008).
- Ulbricht et al.: A review of 5-hydroxymethylfurfural (HMF) in parenteral solutions, Fundamental Applied Toxicology, 1984: 4(5); 843–853.
- Czok: Tolerance of 5-hydroxymethylfurfural (HMF). 2nd communication: pharmacologic effects, Z. Ernährungswiss, 1970: 10(2), 103–110.
- Germond et al.: Rapid and complete urinary elimination of [14C]-5-hydroxymethyl-2-furaldehyde administered orally or intravenously to rats. Toxicol Environ Health, 1987; 22:79–89.
- Jellum et al.: Presence of furan derivatives in patients receiving fructose-containing solutions intravenously, Clinica Chimica Acta, 1973: 47(2);191–201.
- Godfrey et al.: Distribution and metabolism of 5- hydroxymethyl furfural in male F344 rats and B6C3F1 mice after oral administration, Journal of Toxicology and Environmental Health, 1999: 57; 199–210.
- Monien et al.: Conversion of the Common Food Constituent 5-Hydroxymethylfurfural into a Mutagenic and Carcinogenic Sulfuric Acid Ester in the Mouse in Vivo, Chem. Res. Toxicol., 2009, 22 (6), 1123–1128.
- Prior et al.: Identification and Urinary Excretion of Metabolites of 5-(Hydroxymethyl)-2-furfural in Human Subjects following Consumption of Dried Plums or Dried Plum Juice, J Agric Food Chem, 2006; 54(10): 3744-9.
- Surh et al.: 5-Sulfooxymethylfurfural as a possible ultimate mutagenic and carcinogenic metabolite of the Maillard reaction product, 5-hydroxymethylfurfural, Carcinogenesis, 1994, 15 (10), S. 2375–2377.
- Blomqvist et al.: Glutamine and α-Ketoglutarate Prevent the Decrease in Muscle Free Glutamine Concentration and Influence Protein Synthesis after Total Hip Replacement, Metabolism, Vol 44, No 9 (September), 1995: S. 1215–1222.
- Pfliger: Etablierung und Messung der direkten und indirekten antioxidativen Wirkungen von AKG, 5HMF und Vitamin C in Gegenwart von Peroxonitrat, MTUniversity Graz, 2009, 99 Bl, Signatur: II 723159.
- Wagner et al.: The potential antimutagenic and antioxidant effects of Maillard reaction products used as “natural antibrowning” agents, Mol Nutr Food Res., 2007 Apr.; 51(4): 496–50.