Tropan
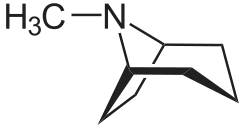
Tropan ist eine bicyclische organische Verbindung. Das Grundgerüst der Verbindung ist in Stoffklassen wie den Tropanolen oder Tropan-Alkaloiden[4] enthalten, die als Medikamente und Giftstoffe von Bedeutung sind. Der Name leitet sich vom Atropin ab, in dessen Molekül es als Strukturelement enthalten ist.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tropan | |||||||||||||||
| Andere Namen |
8-Methyl-8-azabicyclo[3.2.1]octan | |||||||||||||||
| Summenformel | C8H15N | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 125,21 g·mol−1 | |||||||||||||||
| Dichte |
0,9307 g·cm−3[1] | |||||||||||||||
| Siedepunkt |
162–164 °C[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung und Gewinnung
Eine von Robinson und Schöpf schon 1935 beschriebene Synthese startet mit einer Mannich-Reaktion von Succindialdehyd und Methylamin mit Acetondicarbonsäuredimethylester. Dabei wird die Tropangrundstruktur schon gebildet. Die Entfernung der Carbonsäureestersubstitution erfolgt durch eine saure Esterspaltung und anschließende thermische Decarboxylierung.[5] Die Zielverbindung erhält man aus dem erhaltenen Tropinon durch Reduktion mittels Hydrazin[6] oder Hydrierung über Platin(IV)-oxid.[7]
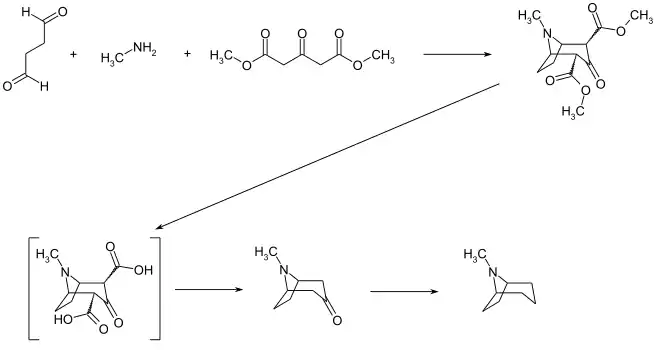
Grundgerüst

Das Grundgerüst des Tropans ist ein heterocyclisches Ringsystem, bei welchem das C-1 und das C-5 Atom eines Piperidin-Ringes durch eine Ethylen-Gruppe miteinander verbunden sind. Das Ringsystem lässt sich auch als Pyrrolidin-Ring interpretieren, bei welchem die Kohlenstoffatome 1 und 4 durch eine Propylen-Gruppe miteinander verbunden sind. Weiterhin weist Tropan am Stickstoff (Position 8) eine Methylgruppe auf. Fehlt die Methylgruppe, spricht man vom Nortropan.
Einzelnachweise
- v. Auwers: In J. prakt. Chemie. 105, 1922, S. 110.
- J.-L. Imbach, A. R. Katritzky, R. A. Kolinski: The conformational analysis of heterocyclic systems. Part VIII. Kinetics of quaternisation of N-alkylpiperidines and N-alkylpiperazines in acetonitrile. In: J. prakt. Chemie. B, 1966, S. 556–562, doi:10.1039/J29660000556.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Eintrag zu Tropan-Alkaloide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2014.
- S. Hauptmann, J. Graefe, H. Remane: Lehrbuch der Organischen Chemie. Deutscher Verlag für Grundstoffindustrie, Leipzig 1980, S. 624.
- P. Wagner, Y. Nakagawa, G. S. Lee, M. E. Davis, S. Elomari, R. C. Medrud, S. I. Zones: Guest/Host Relationships in the Synthesis of the Novel Cage-Based Zeolites SSZ-35, SSZ-36, and SSZ-39. In: J. Am. Chem. Soc. 122, 2000, S. 263–273 doi:10.1021/ja990722u.
- W. Wysocka: Hydrogenolytic Cleavage of C=O Bond in γ-Piperidone Derivatives. In: Heterocycles. 19, 1982, S. 1–5, doi:10.3987/R-1982-01-0001.