1,2,6-Hexantriol
1,2,6-Hexantriol ist ein dreiwertiger Alkohol mit zwei primären und einer sekundären Hydroxygruppe, der in vielerlei Hinsicht Glycerin ähnelt und wegen seiner vorteilhafteren Eigenschaften, wie höhere thermische Stabilität und geringere Hygroskopie, in vielen Anwendungen als Ersatz für Glycerin eingesetzt wird.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||
| Name | 1,2,6-Hexantriol | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C6H14O3 | |||||||||||||||
| Kurzbeschreibung |
viskose, farblose und fast geruchlose Flüssigkeit[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 134,17 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
178 °C (6,5 mbar)[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
vollständig mischbar mit Wasser[2], mischbar mit Aceton[3] und Alkohol[4] | |||||||||||||||
| Brechungsindex |
1,478 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Herstellung
Racemisches 1,2,6-Hexantriol wird durch katalytische Hydrierung des bei der sauren Hydrolyse von Acrolein-Dimer (3,4-Dihydro-2-formyl-2H-pyran) in verdünnter wässriger Lösung entstehenden 2-Hydroxyadipaldehyds (2-Hydroxyhexan-1,6-dial)[6] erhalten.[7][8]
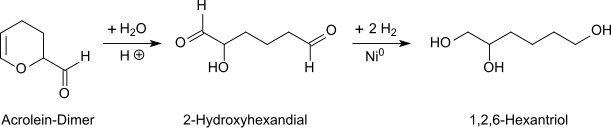
Trotz hoher Produktausbeuten wird auf dieser direkten Route ein leicht gefärbtes Produkt erhalten, und der Hydrierkatalysator wird unter den hohen Aldehydkonzentrationen rasch vergiftet. Für die industrielle Herstellung eignet sich daher die Durchführung der Reaktion in sauren alkoholischen Lösungen,[9] wobei der Alkohol sich schnell an die aktivierte Doppelbindung zum 2-Formyl-6-alkoxytetrahydropyran addiert und anschließend mit der Formylgruppe zum entsprechenden Hemiacetal reagiert.
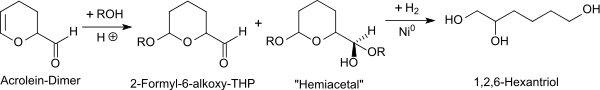
Dem Reaktionsansatz wird Wasser zur Hydrolyse der Acetalgruppen und Raney-Nickel als Hydrierkatalysator zugesetzt. Die Hydrierung unter 20 atm Wasserstoff bei 140 °C ist nach ca. 1,5h abgeschlossen und liefert nach Aufarbeitung reines 1,2,6-Hexantriol in Ausbeuten >95 % d.Th.[9]
Kürzlich wurde von mehreren Autoren auch die Synthese des 1,2,6-Hexantriols aus der einfach zugänglichen Plattformchemikalie Hydroxymethylfurfural (HMF) beschrieben, die aus „kohlenstoffneutralen“ (d. h. aus nachwachsenden) Rohstoffen wie Pentosen, Hexosen, und anderen Kohlenhydraten hergestellt werden kann.[10][11]
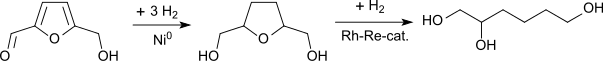
Im ersten Hydrierungsschritt vom HMF zum Tetrahydrofuran-dimethanol zeigt wiederum Raney-Nickel die höchste Katalysatoraktivität. Die weitere Hydrierung führt jedoch auch mit teuren Rhodium-Rhenium-Katalysatoren nur zu bescheidenen Selektivitäten und unbefriedigenden Raum-Zeit-Ausbeuten.
Eigenschaften
1,2,6-Hexantriol ist eine klare, geruchlose, viskose, hochsiedende und hygroskopische Flüssigkeit, die mit Wasser und polaren organischen Lösungsmitteln mischbar, mit nicht-polaren[3], wie Benzol, Diethylether oder Heptan nicht mischbar ist.[12] Die Verbindung ähnelt in ihren Eigenschaften dem einfachsten Triol Glycerin, ist aber bei geringerer Dichte deutlich viskoser und nur etwa halb so hygroskopisch wie Glycerin. Wegen seiner geringeren Polarität und seines höheren Molekülvolumens bildet 1,2,6-Hexantriol oft stabilere Mischungen oder Emulsionen, besonders mit unpolaren Komponenten und ist daher auch ein brauchbarer Weichmacher.[3]
Anwendungen
1,2,6-Hexantriol dient wegen seiner niedrigen Toxizität und guten Verträglichkeit als Lösungsmittel, zur Viskositätserhöhung von flüssigen und halb-festen kosmetischen[13] und pharmazeutischen Zubereitungen, sowie wegen seiner Hygroskopie als Feuchthaltemittel.[8] Als Adjuvant in Pflanzenschutzmittelformulierungen verbessert 1,2,6-Hexantriol die Wirksamkeit der Aktivsubstanzen. In Tinten und Farben stabilisiert es die Dispersion der Pigmente. Auch in Hydraulikflüssigkeiten und als Korrosionsinhibitoren[14] finden Derivate des 1,2,6-Hexantriols Verwendung. Als trifunktionelles Molekül fungiert 1,2,6-Hexantriol als Polyol in Polyurethanen und als Vernetzer in Polyestern und Alkydharzen.[15] Ester von 1,2,6-Hexantriol mit längerkettigen Carbonsäuren sind brauchbare Weichmacher für PVC[8] und Celluloseacetat, sowie für Kautschukpolymere, wie Nitrilkautschuk (NBR) und Neopren.[3] 1,2,6-Hexantriol wird als Monomer für die Synthese von Polyorthoestern des Typs POE III, die sich wegen der hohen Flexibilität des Triols durch eine salbenartige Konsistenz auszeichnen und als Wirkstoffdepotmaterialien für ophthalmologische Anwendungen geprüft wurden.[16]
Einzelnachweise
- Eintrag zu 1,2,6-HEXANETRIOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. Januar 2022.
- Eintrag zu 1,2,6-Hexantriol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. August 2014. (JavaScript erforderlich)
- Sigma-Aldrich : Technical Bulletin AL-128, 1,2,6-Hexanetriol,
- Fisher Scientific: 1,2,6-Hexanetriol 97%
- Eintrag zu 1,2,6-Hexanetriol in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- D.Arntz, A. Fischer, M. Höpp, J. S. Jacobi, Sauer, T. Ohara, T. Sato, N. Shimizu, H. Schwind: Ullmann’s Encyclopedia of Industrial Chemistry. Acrolein and Methacrolein. Wiley-VCH, 2007, doi:10.1002/14356007.a01_149.pub2.
- H. Schulz, H. Wagner: Synthese und Umwandlungsprodukte des Acroleins. In: Angew. Chem. Band 62, Nr. 5, 1950, S. 105–118, doi:10.1002/ange.19500620502.
- Patent US2768213: 1,2,6-Hexanetriol. Veröffentlicht am 23. Oktober 1956, Anmelder: Shell Development Co., Erfinder: R. Whetstone, S.A. Ballard.
- Patent US3773842: Process for the preparation of 1,2,6-hexanetriol. Veröffentlicht am 20. November 1973, Anmelder: Ugine Kuhlmann, Erfinder: J.-P. Schirmann, F. Weiss.
- Patent WO2011149339: Preparation of caprolactone, caprolactam, 2,5-tetrahydrofuran-dimethanol, 1,6-hexanediol or 1,2,6-hexanetriol from 2-hydroxymethyl-5-furfuralaldehyde. Angemeldet am 23. März 2011, Anmelder: Netherlands Organisation for Scientific Research, Erfinder: J.G. De Vries, T. Bundara, P. Huat Phua, I.V. Melian Cabrera.
- S. Yao, X. Wang, Y. Jiang, F. Wu, X. Chen, X. Mu: One-Step Conversion of Biomass-Derived 5-Hydroxymethylfurfural to 1,2,6-Hexanetriol Over Ni–Co–Al Mixed Oxide Catalysts Under Mild Conditions. In: ACS Sustainable Chem. Eng. Band 2, 2014, S. 173–180, doi:10.1021/sc4003714.
- Datenblatt 1,2,6-Hexanetriol, 97+%, extra pure bei Acros, abgerufen am 28. Oktober 2014.
- SAA Pedia: 1,2,6-Hexanetriol
- Patent US3403104: Borate corrosion inhibitors. Veröffentlicht am 24. September 1968, Anmelder: Union Carbide Corp., Erfinder: P.B. Sullivan.
- R.W. Tess, R.D. Harline, T.F. Mika: 1,2,6-Hexanetriol in Alkyd Resins. In: Ind. Eng. Chem. Band 49, Nr. 3, 1957, S. 374–378, doi:10.1021/ie51392a028.
- Jorge Heller: 6. Poly (Ortho Esters). In: A.J. Domb, J. Kost, D.M. Wiseman (Hrsg.): Handbook of Biodegradable Polymers. Harwood Academic Press, 1997, ISBN 90-5702-153-6, S. 99–118.