Steroid-5α-Reduktase
Steroid-5α-Reduktase (SRD5) (auch Testosteron-5α-Reduktase oder kurz 5α-Reduktase) ist der Name für drei bekannte Enzyme, die in Wirbeltieren vorkommen und einander sehr ähnlich sind (sogenannte Isozyme).
| Steroid-5α-Reduktase 1 | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 259 Aminosäuren; 29,5 kDa | |
| Bezeichner | ||
| Gen-Namen | SRD5A1 ; S5AR | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.3.99.5, Oxidoreduktase | |
| Reaktionsart | Hydrierung | |
| Substrat | 3-Oxo-Δ4,5-Steroid | |
| Produkte | 3-Oxo-5α-Steroid | |
| Vorkommen | ||
| Übergeordnetes Taxon | Euteleostomi | |
| Orthologe | ||
| Mensch | Maus | |
| Entrez | 6715 | 78925 |
| Ensembl | ENSG00000145545; | ENSMUSG00000021594 |
| UniProt | P18405 | Q68FF9 |
| Refseq (mRNA) | NM_001047 | NM_175283 |
| Refseq (Protein) | NP_001038 | NP_780492 |
| Genlocus | Chr 5: 6.69 – 6.72 Mb | Chr 13: 69.71 – 69.75 Mb |
| PubMed-Suche | 6715 | 78925 |
| Steroid-5α-Reduktase 2 | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 254 Aminosäuren; 28,4 kDa | |
| Bezeichner | ||
| Gen-Name | SRD5A2 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.3.99.5, Oxidoreduktase | |
| Reaktionsart | Hydrierung | |
| Substrat | 3-Oxo-Δ4,5-Steroid | |
| Produkte | 3-Oxo-5α-Steroid | |
| Vorkommen | ||
| Übergeordnetes Taxon | Euteleostomi | |
| Orthologe | ||
| Mensch | Maus | |
| Entrez | 6716 | 94224 |
| Ensembl | ENSG00000049319 | ENSMUSG00000038541 |
| UniProt | P31213 | Q99N99 |
| Refseq (mRNA) | NM_000348 | NM_053188 |
| Refseq (Protein) | NP_000339 | NP_444418 |
| Genlocus | Chr 2: 31.6 – 31.66 Mb | Chr 17: 74.37 – 74.4 Mb |
| PubMed-Suche | 6716 | 94224 |
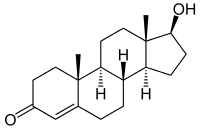
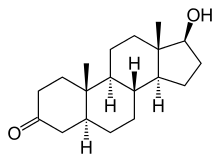
Die 5α-Reduktase (SRD5) wandelt unter anderem in den Zielzellen das Geschlechtshormon Testosteron in seine biologisch aktivste Form Dihydrotestosteron (DHT) um und ist damit für die Wirkungen dieses Hormons unbedingt notwendig. Das Dihydrotestosteron gehört zu den Androgenen und ihre Wirkung am betreffenden Androgenrezeptor ist wesentlich stärker als diejenige von Testosteron. DHT ist unter anderem für die Bildung der inneren und äußeren männlichen Geschlechtsteile während der Embryonalentwicklung im Mutterleib zuständig.
Unterbleibt durch einen Mangel der Steroid-5α-Reduktase (insbesondere des zweiten Isozyms SRD5A2) die Umwandlung von Testosteron zu DHT, so kann es während der Schwangerschaft bei männlichen Ungeborenen zur Bildung eines Pseudohermaphroditismus mit einer Hypospadie des Penis kommen, bei dem die äußere Öffnung der Harnröhre im Dammbereich liegt.[1] Bei weiblichen Ungeborenen hat der Enzymmangel keinen Einfluss auf die Entwicklung des Körpers. Ein Haplotyp von SRD5A2 mit folglich erhöhter 5α-Reduktase-Aktivität wurde bei Frauen mit einem erhöhten Risiko für das polyzystische Ovarialsyndrom in Verbindung gebracht. Andererseits hat die Hemmung der Enzyme günstige Wirkungen bei Krankheiten der Prostata und bei Haarausfall.
Struktur
Vom Enzym existieren drei Isoformen, die als 5α-Reduktase Typ I, Typ II und Typ III bezeichnet werden und deren Gene (SRD5A1, SRD5A2 und SRD5A3) auf verschiedenen Chromosomen (5, 2 und 4) liegen. Die Primärstruktur der beiden hydrophoben Membranproteine (5α-Reduktase Typ I und Typ II) besteht aus 259 bzw. 254 Aminosäuren, mit einer Molekülmasse von 29.459 bzw. 28.393 Da.[2][3][4][5]
Biologische Funktion
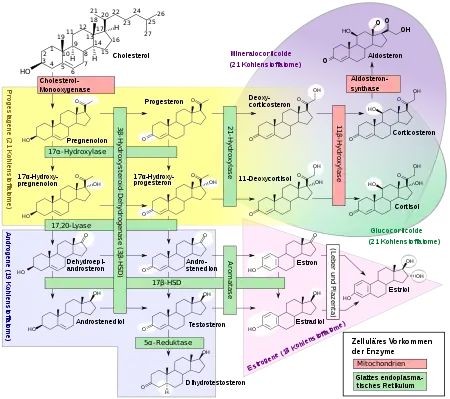 Metabolismus der Steroidhormone
Metabolismus der Steroidhormone
Steroid-5α-Reduktase ist ein NADPH-abhängiges Enzym aus der Gruppe der Oxidoreduktasen, welches irreversibel die Reduktion von 3-Oxo-Δ4,5-Steroiden zu den korrespondierenden 3-Oxo-5α-Verbindungen katalysiert. Die mit Abstand wichtigste Reaktion ist dabei die Umwandlung des Sexualhormons Testosteron in das biologisch wirksamere Dihydrotestosteron (DHT).[6]
Physiologie
Die Isoenzyme der 5α-Reduktase werden in vielen Organen beziehungsweise Geweben des menschlichen Körpers in unterschiedlichem Ausmaß produziert:
- Typ I (SRD5A1) findet man hauptsächlich im Gehirn, in den Nebenhoden und in der Haut. Er spielt eine wichtige Rolle bei der Biosynthese von Allopregnanolon, wobei er Progesteron in 5α-Dihydroprogesteron umwandelt, welches über einen weiteren Schritt letztendlich zu Allopregnanolon (ALLO) umgewandelt wird. Es ist, wie das Tetrahydrodeoxycorticosteron (THDOC), ein positiver allosterischer Modulator der GABAA-Rezeptoren, welche den gleichen Wirkungsort von euphorisierenden und angstlösenden Medikamenten, wie z. B. Benzodiazepinen, besitzen.[7]
- Typ II (SRD5A2) befindet sich hauptsächlich in den Muskeln, Leber, Nieren, Prostata und wird jedoch nur zu einem sehr geringen Teil in der Haut produziert. Bei einer benignen Prostatahyperplasie (BPH) findet man eine starke Erhöhung dieses Typs.
- Typ III (SRD5A3) Dieser erst später entdeckte und wohl wichtigste Typ wird vor allem im Gehirn, in Brustdrüsen, Gebärmutterhals, Haut, Eierstöcken, Hoden, Prostata, Pankreas, Milz, Nieren, Herz, Magen und Leber produziert. Auch hier findet sich eine leichte Erhöhung bei der BPH.[4][5] Des Weiteren ist Typ III für die Glykosylierung von großer Bedeutung: es wandelt Polyprenol zu Dolichol um. Das Gen dieses Typs, SRD5A3, ist bei Patienten mit einer Form der Congenital Disorder of Glycosylation (CDG) mutiert.[8]
Eine erhöhte Produktion des Enzyms findet auch in polyzystischen Ovarien der Frau statt, weshalb es möglicherweise eine Rolle beim polyzystischen Ovarialsyndrom spielt.[9]
Der Mangel oder gar die Abwesenheit vom Typ II im männlichen Fötus kann zur Hypospadie und Intersexualität führen.[10]
Verursacher des 5-Alpha-Reduktase 2-Mangels sind vielfältige Mutationen des 5α-Reduktase-2-Gens (SRD5A2-Gens)[11],[12] betreffen aber gehäuft die Genabschnitte Exon 2 und Exon 4.[13] Neben homozygoten Mutationen treten auch unterschiedliche Mutationen in beiden Allelen (Compound-Heterozygotie) auf.[14]
Pharmakologie
5α-Reduktase-Inhibitoren sind Arzneimittel, die beispielsweise in der Therapie der benignen Prostatahyperplasie (BPH) und bei androgener Alopezie Verwendung finden. Beispiele hierfür sind Finasterid und Dutasterid. Finasterid blockiert die Funktion der Isoenzyme Typ II und Typ III, während Dutasterid alle drei Isoenzyme inhibiert.[5] Diese Inhibitoren leiten sich von der Struktur des Testosteron ab. Es ist bisher noch nicht gelungen, die Strukturen der Isoenzyme mittels Röntgenstrukturanalyse näher zu untersuchen. Die einzig verfügbare Information ist die von der cDNA abgeleitete Primärstruktur der Proteine.[6] Die Ausbildung von Gynäkomastie, Depressionen, erektiler Dysfunktion und Libidoverlust sind einige der möglichen Nebenwirkungen der 5α-Reduktase-Inhibitoren Finasterid und Dutasterid.[15]
Literatur
- S. Andersson et al.: Deletion of steroid 5 alpha-reductase 2 gene in male pseudohermaphroditism. In Nature., Band 354, Nummer 6349, November 1991, S. 159–161, doi:10.1038/354159a0, PMID 1944596, PMC 4451825 (freier Volltext).
- Julianne Imperato-McGinley et al.: Steroid 5alpha-reductase deficiency in man: an inherited form of male pseudohermaphroditism. In Science., Band 186, Nummer 4170, Dezember 1974, S. 1213–1215, PMID 4432067.
- S. Andersson et al.: Structural and biochemical properties of cloned and expressed human and rat steroid 5 alpha-reductases. In: Proceedings of the National Academy of Sciences., Band 87, Nummer 10, Mai 1990, S. 3640–3644, PMID 2339109, PMC 53958 (freier Volltext).
- D. W. Russell et al.: Steroid 5 alpha-reductase: two genes/two enzymes. In Annual Review of Biochemistry., Band 63, 1994, S. 25–61, doi:10.1146/annurev.bi.63.070194.000325, PMID 7979239 (Review).
- T. Ishikawaet al.: Aromatase-independent testosterone conversion into estrogenic steroids is inhibited by a 5 alpha-reductase inhibitor. In: The Journal of steroid biochemistry and molecular biology., Band 98, Nummer 2–3, Februar 2006, S. 133–138, doi:10.1016/j.jsbmb.2005.09.004, PMID 16386416.
- A. Iranmanesh et al.: Combined inhibition of types I and II 5 alpha-reductase selectively augments the basal (nonpulsatile) mode of testosterone secretion in young men. In: Journal of clinical endocrinology and metabolism. Band 90, Nummer 7, Juli 2005, S. 4232–4237, doi:10.1210/jc.2004-2262, PMID 15811930.
- M. H. Choi et al.: Biochemical roles of testosterone and epitestosterone to 5 alpha-reductase as indicators of male-pattern baldness. In Journal of Investigative Dermatology., Band 116, Nummer 1, Januar 2001, S. 57–61, doi:10.1046/j.1523-1747.2001.00188.x, PMID 11168798.
Weblinks
- Bruce E Wilson: 5-Alpha-Reductase Deficiency
Einzelnachweise
- Victor A. McKusick: #264600; Pseudovaginal Perineoscrotal Hypospadias; PPSH. Online Mendelian Inheritance in Man (OMIN), 4. Juni 1986, reorganisiert: 18. Oktober 2002; abgerufen am 15. November 2020.
- UniProt P31213
- UniProt P18405.
- A. Godoy, E. Kawinski u. a.: 5α-reductase type 3 expression in human benign and malignant tissues: a comparative analysis during prostate cancer progression. In: The Prostate. Band 71, Nummer 10, 2011, S. 1033–1046. doi:10.1002/pros.21318. PMID 21557268.
- K. Yamana, F. Labrie u. a.: Human type 3 5α-reductase is expressed in peripheral tissues at higher levels than types 1 and 2 and its activity is potently inhibited by finasteride and dutasteride. In: Hormone Molecular Biology and Clinical Investigation, Band 2, Nr. 3, 1. August 2010.
- M. Streiber: Hybridinhibitoren der humanen 5α-Reduktase: Ein neues Konzept zur Hemmung der 5α-Reduktase Isoenzyme Typ I und Typ II. Dissertation, Universität Saarbrücken, 2006, urn:nbn:de:bsz:291-scidok-10733.
- BG Gunn, AR Brown, JJ Lambert, D Belelli: Neurosteroids and GABA(A) Receptor Interactions: A Focus on Stress. In: Frontiers in Neuroscience. 5, 2011, S. 131. doi:10.3389/fnins.2011.00131. PMID 22164129. PMC 3230140 (freier Volltext).
- V. Cantagrel, D. J. Lefeber u. a.: SRD5A3 is required for converting polyprenol to dolichol and is mutated in a congenital glycosylation disorder. In: Cell. Band 142, Nummer 2, Juli 2010, S. 203–217, ISSN 1097-4172. doi:10.1016/j.cell.2010.06.001. PMID 20637498. PMC 2940322 (freier Volltext).
- SRD5AR2. In: Online Mendelian Inheritance in Man. (englisch).
- Pseudovaginal Perineoscrotal Hypospadia. In: Online Mendelian Inheritance in Man. (englisch).
- Gene 6716 (uid); SRD5A2 steroid 5 alpha-reductase 2; Homo sapiens (human). The National Center for Biotechnology Information (NBC); aktualisiert: 2. September 2020; abgerufen am 15. November 2020.
- OMIM genes - 607306. UCSC Genome Informatics Group - Online Mendelian Inheritance in Man (OMIN), aktualisiert: 11. November 2020; abgerufen am 15. November 2020.
- Bild: Mutationen im SRD5A2-Gen. marlin-prod.literatumonline.com; abgerufen am 23. Februar 2019.
- L. Maimoun, P. Philibert, B. Cammas et al.: Phenotypical, biological, and molecular heterogeneity of 5alpha-reductase deficiency: an extensive international experience of 55 patients. In: The Journal of clinical endocrinology and metabolism, Band 96, Nummer 2, Februar 2011, S. 296–307, ISSN 1945-7197, doi:10.1210/jc.2010-1024, PMID 21147889.
- J. M. Hirshburg, P. A. Kelsey, C. A. Therrien, A. C. Gavino, J. S. Reichenberg: Adverse Effects and Safety of 5-alpha Reductase Inhibitors (Finasteride, Dutasteride): A Systematic Review. In: The Journal of clinical and aesthetic dermatology. Band 9, Nummer 7, Juli 2016, S. 56–62, PMID 27672412, PMC 5023004 (freier Volltext) (Review).