Dihydrotestosteron
Dihydrotestosteron (DHT), genauer 5α-Dihydrotestosteron, auch Androstanolon (INN), ist ein biologisch aktiver Metabolit des Hormons Testosteron. Es ist ein C-19-Steroid und zählt zu den Androgenen, einer Klasse von Sexualhormonen.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Androstanolon | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C19H30O2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 290,44 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Physiologie
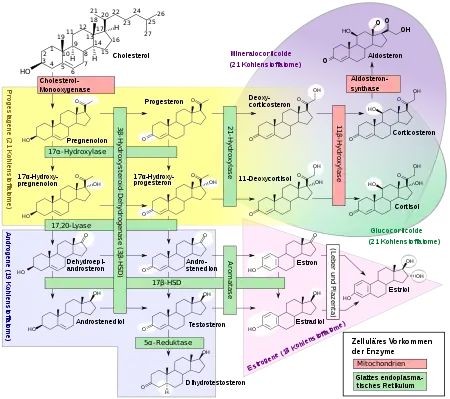
DHT wird im Körper durch das Enzym 5α-Reduktase aus Testosteron gebildet. DHT ist die biologisch aktivste Form des Testosterons. In vielen Organen ist DHT das eigentlich wirksame Androgen.
Testosteron selbst ist ein Prohormon für zwei Hormone: DHT und Estradiol. DHT ist ein reines Androgen, da es nicht zu Estradiol aromatisiert werden kann.[2] Auch wenn Testosteron und DHT über denselben Rezeptor wirken, ist ihre Wirkung dennoch unterschiedlich. Während Testosteron die Differenzierung der Wolffschen Gänge induziert, ist Dihydrotestosteron für die äußerliche Virilisierung und für das Wachstum und die Differenzierung der Prostata verantwortlich.[3] Über die Blutbahn gelangt das Testosteron in die androgenabhängigen Zellen. Intrazellulär bindet das Hormon entweder direkt an den Androgenrezeptor oder wird durch die 5α-Reduktase zu dem biologisch noch wirksameren DHT metabolisiert, das dann seine Wirkung ebenfalls über den Androgenrezeptor entfaltet. Der Hormon-Rezeptor-Komplex gelangt in den Zellkern und bindet dort an spezifische Hormone Response Elemente (HRE) in der Promoter-Region androgenregulierter Gene. Dabei kontrolliert dieser Komplex so die Aktivität und die spezifische Zellantwort dieser Gene.[3]
Im weiblichen Organismus
Bei der Frau entsteht DHT aus Testosteron und Androstendion. Nur etwa 1 % des DHT zirkuliert frei, während der überwiegende Teil fest an Sexualhormon-bindendes Globulin (SHBG) gebunden ist. DHT wird durch Reduktion zu 17-Ketosteroiden inaktiviert und über den Urin ausgeschieden.[2] Die Bildungsorte der weiblichen Androgene (C-19 Steroide) sind die Thekazellen (der äußeren Zellschicht um einen Follikel) in den Ovarien und Bereiche der Nebennierenrinde. Das hormonell wirksamste Androgen am Steroidrezeptor stellt das DHT dar, weniger wirksam sind das Dehydroepiandrosteron (DHEA) und das Dehydroepiandrosteronsulfat (DHEAS). Das aus dem DHEA mittels des Enzyms 3β-Hydroxysteroid-Dehydrogenase entstehende schwach wirksame Androstendion entstammt ebenfalls zu etwa 90 % aus den Thekazellen, die restlichen 10 % werden in den peripheren Geweben aus dem DHEA umgewandelt.[4] Das Androstendion stellt aber einen Präkursor für die weibliche Testosteron-Synthese dar. Diese Synthese bzw. Freisetzung in den weiblichen Gonaden wird durch das Luteinisierendes Hormon (LH) des Hypophysenvorderlappen (Beispiele für hormonelle Regulation) nach dessen Stimulation durch das Releasing-Hormon Gonadoliberin (GnRH) rückgekoppelt geregelt, hingegen in der Nebennierenrinde durch das Adrenocorticotropin (ACTH).
Die im (adulten) weiblichen Organismus gebildeten Androsterone dienen zumeist als Vorstufe (Präkursor) der Östrogensynthese (C-18 Steroide). Das Sexualhormon-bindendes Globulin (SHBG) ist das spezifische Transportprotein für Sexualhormone, wobei nur das nicht-gebundene, „freie“ DHT seine physiologische Wirkung zeigt. Da einige weitere biologisch aktive Moleküle um die Bindungsstellen auf dem SHBG konkurrieren können eine Schwangerschaft, aber auch Thyroxin zu einer Spiegelveränderung etwa des DHT oder anderer Androgene führen.
Im männlichen Organismus
Kleine Mengen DHT werden bei Männern direkt in den Hoden gebildet. Dihydrotestosteron ist die erst in den Zielzellen gebildete Wirkform des Testosterons. Entwicklung und Funktion von Prostata und Bläschendrüsen, Körperbehaarung männlichen Typs, Bartwuchs, die Funktion der Talgdrüsen, aber auch die Abnahme der Kopfbehaarung bei genetischer Disposition sind Prozesse, die vom DHT gesteuert werden.[2] Ist die Umwandlung von Testosteron zu dem für die Maskulinisierung der externen Genitalanlage notwendigen Dihydrotestosteron (DHT) wie beispielsweise bei einem 5α-Reduktase-2-Mangel gestört, führt das bei genotypischen männlichen Individuen zu verschiedenen Formen der genitalen Fehlbildungen.[5][6] Das DHT ermöglicht insbesondere die männliche Entwicklung der äußeren Genitalien, aber auch der Prostata. Aus dem Sinus urogenitalis entstehen der Penis und das Scrotum, in das die sich unter dem Einfluss des DHT vergrößernden Hoden hinabsteigen.
Funktion und Nebenwirkungen
Funktion und Nebenwirkungen von DHT entsprechen denen seines Prohormons Testosteron.
Diagnostik
Die Diagnostik von DHT ist für folgende Indikationen gegeben:[2]
- Beurteilung und Verlaufskontrolle Pseudohermaphroditismus
- Verdacht auf genetischen 5α-Reduktase-Mangel
- Therapiekontrolle von 5α-Reduktase-Hemmern (Finasterid, Dutasterid), beispielsweise bei der Behandlung der benignen Prostatahyperplasie (BPH) oder Prostatakrebs
- Androgenisierungserscheinungen bei der Frau, wie zum Beispiel Hirsutismus, Virilisierung, Alopezie
Niedrige DHT-Konzentrationen
Niedrige DHT-Spiegel finden sich beispielsweise bei:[2]
- Pseudohermaphroditismus masculinus
- 5α-Reduktase-Mangel
- Klinefelter-Syndrom
- Primärem und sekundärem Hypogonadismus
- Erektile Dysfunktion (Impotenz)
- Leberzirrhose
- Estrogentherapie
- Therapie mit 5α-Reduktase-Hemmern wie Finasterid und Dutasterid
Erhöhte DHT-Konzentrationen
Hohe DHT-Spiegel können vorliegen bei:[2]
- Chronischen Anovulationssyndromen, wie beispielsweise dem PCO-Syndrom
- Hirsutismus
- Pubertas praecox
- Angeborene Nebennierenrinden-Hyperplasie
- Nebennierenrinden-Tumoren, Hodentumoren, Ovarialtumoren
Bei jungen Männern liegt der DHT-Spiegel bei etwa 10 % des Gesamt-Testosteronspiegels.[2] Ein erhöhter Testosteron-/DHT-Quotient nach HCG-Stimulation (HCG-Test, Leydig-Zell-Funktionstest) weist auf einen 5α-Reduktase-Mangel hin.[2]
Prostatahyperplasie
DHT stimuliert das Wachstum der Prostata. Wird die Funktion von DHT gehemmt, führt dies zur Verkleinerung der Prostata. Diese Therapieform wird häufig bei der benignen (gutartigen) Prostatahyperplasie (BPH) eingesetzt. Dazu werden 5α-Reduktase-Hemmer mit den Wirkstoffen Finasterid oder Dutasterid oral eingenommen.[2]
Androgenetische Alopezie („Haarausfall“)
Die androgenetische Alopezie (AGA), auch als erblich bedingter Haarausfall bezeichnet, ist bei Männern weit verbreitet. Sie bezeichnet die genetisch bedingte Empfindlichkeit der Haarwurzeln gegenüber dem Hormon DHT. Die Empfindlichkeit der Haarwurzeln betrifft nur die Haare am Oberkopf, bei der die Haarfollikel durch DHT geschädigt und geschwächt werden.[7]
Doping
Der prozentuale Anteil der Anwender von Dihydrotestosteron im Bodybuilding ist in den letzten Jahren angestiegen. Immer mehr Bodybuilder verwenden DHT, um ihren Androgenspiegel weit über das natürliche Limit zu bringen. Was einerseits großen Muskelwachstum bewirkt, bringt zusätzlich diverse Nebenwirkungen mit sich. Herzrhythmusstörungen, Leber- und Nierentumorbildung, Arteriosklerose sowie Gynäkomastie (Anschwellen der Brustdrüsen beim Mann)[8] sind nur einige der Nebenwirkungen, die bei Verwendung von DHT auftreten können.
Bei weiblichen Sportlern ist eine deutliche Zunahme der Körperbehaarung (Hirsutismus) im Gesichtsbereich möglich, und es kann Steroidakne auftreten. Weiterhin wird ein Haarverlust mit Glatzenbildung begünstigt, es kann sich eine (permanent) tiefe Stimme einstellen und eine permanente Klitorisvergrößerung (Klitorishypertrophie) auftreten. Ebenfalls sind Zyklusstörungen sowie Brustgrößeveränderungen nachgewiesen; bei Schwangeren ist mit Störung der Embryonal- und Fetalentwicklung (Geschlechtsdetermination) zu rechnen.
Literatur
- O. Hiort et al.: Androgenresistenzsyndrome – Klinische und molekulare Grundlagen. In: Deutsches Ärzteblatt. Nr. 96/ 1999, S.A-686/B-560/C-527.
- A. Kjellman et al.: Is dihydrotestosteron a prognostic factor among men with screening-detected prostate cancer? In: European Urology Supplements. Nr. 5/ 2006, S. 319.
- R. Paus: Therapeutic strategies for treating hair loss. In: Drug Discovery Today: Therapeutic Strategies. nr. 3/ 2006, S. 101–110.
- Julianne Imperato-Mcginley, Vivian Sobel, Yuan-Shan Zhu: Fetal hormones and sexual differentiation. In: Obstetrics and Gynecology Clinics of North America. Band 31, Nr. 4, Januar 2005, S. 837–856, doi:10.1016/j.ogc.2004.08.005 (Volltext).
Weblinks
- Dihydrotestosterone Compound – C03917 in der Kyoto Encyclopedia of Genes and Genomes
Einzelnachweise
- Datenblatt 5α-Androstan-17β-ol-3-one bei Sigma-Aldrich, abgerufen am 3. November 2021 (PDF).
- Endokrinologikum.com: Dihydrotestosteron (Memento vom 9. Oktober 2007 im Internet Archive), abgerufen am 7. August 2007.
- Genetikzentrum: Prostatakarzinom-Risikoanalyse (Memento vom 20. Oktober 2011 im Internet Archive), abgerufen am 8. August 2007.
- Thomas Weyerstahl, Manfred Stauber: Duale Reihe Gynäkologie und Geburtshilfe. Thieme, Stuttgart 2013, ISBN 978-3-13-152604-5, S. 100–102.
- Julianne Imperato-McGinley, Yuan-Shan Zhu: Androgens and male physiology—The syndrome of 5 alpha-reductase-2 deficiency. In: Molecular and Cellular Endocrinology. Band 19, Nr. 1, Dezember 2002, S. 51–59, doi:10.1016/S0303-7207(02)00368-4 (researchgate.net Volltext).
- Hey-Joo Kang, Julianne Imperato-McGinley, Yuan-Shan Zhu, Zev Rosenwaks: The effect of 5α-reductase-2 deficiency on human fertility. In: Fertility and sterility. Band 101, Nr. 2, Januar 2014, S. 310–316, doi:10.1016/j.fertnstert.2013.11.128 (fertstert.org Volltext).
- bnw-natur.com: Hormoneller Haarausfall (Memento vom 13. August 2007 im Internet Archive), abgerufen am 8. August 2007.
- R. D. Goldman: Drug-induced gynecomastia in children and adolescents. In: Canadian family physician Medecin de famille canadien. Band 56, Nummer 4, April 2010, S. 344–345, PMID 20393092, PMC 2860825 (freier Volltext).