Wohl-Abbau
Der Wohl-Abbau (auch bekannt als Wohl-Reaktion oder Wohl-Zucker-Abbau) ist eine Namensreaktion der organischen Chemie. Die Reaktion wurde benannt nach ihrem Entdecker, dem deutschen Chemiker Alfred Wohl (1863–1939). Hierbei handelt es sich um eine Degradation einer Aldose, die unter Einbeziehung einer umgekehrte Kiliani-Fischer-Synthese, um ein Kohlenstoffatom verkürzt wird.[1][2] Damit lassen sich dann beliebige kleinere Aldosen herstellen, wie zum Beispiel Ribose, der bekannt dafür ist in der RNS (Ribonukleinsäure), ADP (Adenosindiphosphat) und AMP (Adenosinmonophosphat) vorzukommen.
Übersichtsreaktion
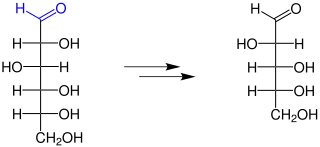
Bei dieser Reaktion geht es um die Verkürzung der Kohlenstoffkette eines Zuckers. Das wird erreicht durch die Umsetzung des Zuckers mit Acetanhydrid (Essigsäureanhydrid), Hydroxylamin, Natriumacetat, Natriummethanolat und Salzsäure. Anschließend kann eine Deacylierung durchgeführt werden, um den Zucker zu erhalten.[3][2]
Reaktionsmechanismus
Der nachfolgende Reaktionsmechanismus stammt aus dem Buch Comprehensive Organic Name Reactions and Reagents und ist nur ein möglicher Reaktionsmechanismus:[1]

Die als cyclisches Halbacetal in Fischer-Projektion gezeichnete Aldohexose (1) erleidet durch Hinzugabe von Hydroxylamin eine Ringspaltung. Das geschieht in dem sich das Hydroxylamin am partiell stärksten positiv geladenen Kohlenstoffatom anlagert und sich eine Hydroxygruppe ausbildet. Durch Verschiebung der Elektronen kann ein Oxim (2) entstehen, hierfür wird ein Proton vom Stickstoff- und die Hydroxygruppe vom Kohlenstoffatom abgespalten. Anschließend wird Natriumacetat und Essigsäureanhydrid (in diesem Reaktionsmechanismus mit „Ac2O“ abgekürzt, wobei „Ac“ ein Acetylrest ist) hinzugefügt, wodurch eine Acetylierung durchgeführt wurde. Durch Erhitzen der Lösung, auf über 110 °C, spaltet sich Essigsäure ab und es entsteht das Nitril (3). Das so entstandene Nitril (3) wird nun mit Natriummethanolat umgesetzt, hierbei wird Natriumcyanid abgespalten und durch Methanolat ersetzt. Die Salzsäure sorgt nun dafür, dass sich Essigsäuremethylester abspaltet, so entsteht ein Aldehyd (4) – eine vierfach acetylierte Aldopentose. Anschließend muss nur die Deacetylierung durchgeführt werden, wodurch die Aldopentose (5) entsteht.
Einzelnachweise
- Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 3057.
- A. Wohl: Abbau des Traubenzuckers. In: Berichte der deutschen chemischen Gesellschaft. 26, Nr. 1, 1893, S. 730–744. doi:10.1002/cber.189302601150.
- M. Windholz (Hrsg.): The Merck Index. Ninth Edition. Merck & Co., 1976, S. ON-95, ISBN 978-0-911910-26-1.