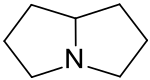
Pyrrolizidin
Pyrrolizidin ist ein anelliertes bicyclisches Pyrrolidin, dessen Stickstoffatom beiden fünfgliedrigen Ringsystemen angehört. Das tertiäre Amin ist das Grundgerüst für Pyrrolizidinalkaloide (PA), die in Pflanzen weit verbreitet sind und wegen der Bildung giftiger Metaboliten im tierischen Organismus eine erhebliche Gefährdung für Pflanzenfresser (und Menschen) darstellen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Pyrrolizidin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H13N | ||||||||||||||||||
| Kurzbeschreibung |
piperidinartig riechende Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 111,18 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Ethanol[3], Diethylether[1] | ||||||||||||||||||
| Brechungsindex | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
Wegen seiner geringen Stabilität kommt das unsubstituierte Pyrrolizidin nicht natürlich vor. Einfache Derivate sind z. B. 1-Hydroxymethylpyrrolizidin (Isoretronecanol oder Necinbase) bzw. dessen 1,2-Dehydroform.
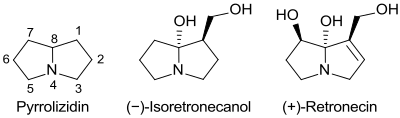
Die daraus abgeleiteten Ester bilden eine wichtige Teilmenge der Pyrrolizidinalkaloide.[7]
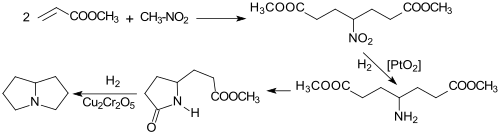
Für die chemische Synthese von Pyrrolizidin wurden von Nelson J. Leonard und Mitarbeitern mehrere Varianten vorgeschlagen. So liefert die katalytische Hydrierung von 4-Nitropimelinsäuredimethylester (aus Methylacrylat und Nitromethan[8][1]) an einem Platin(IV)-oxid-Kontakt zunächst den 4-Aminoester, der zum substituierten 2-Pyrrolidon cyclisiert. Nach Katalysatorwechsel zu Kupferchromit Cu2Cr2O5 wird bei hohem Druck und Temperatur Pyrrolizidin in 60 %iger Ausbeute erhalten.[9]
Ausgehend von Acetondicarbonsäurediestern kann Pyrrolizidin über die Zwischenverbindung Diethyl-4-oxopimelat[10] unter milderen Bedingungen, aber in umständlicher mehrstufiger Reaktion in ähnlichen Ausbeuten erzeugt werden.[4]
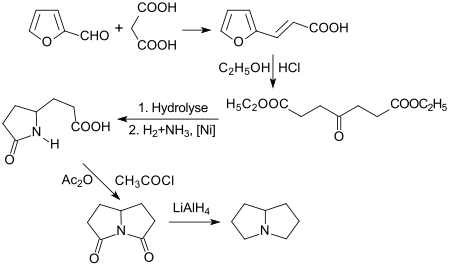
Die Zwischenverbindung Diethyl-4-oxoheptandisäureester erhält man auch durch saure Alkoholyse von Furfuracrylsäure (aus Furfural und Malonsäure[11]) mit Ethanol (Ausbeute 71 %).[12] Hydrolyse zur 4-Oxoheptandisäure, Hydrierung in Gegenwart von Ammoniak unter Ringschluss zum substituierten 2-Pyrrolidon und weitere Cyclisierung mit Acetanhydrid/Acetylchlorid liefert 3,5-Dioxopyrrolizidin (Rolziracetam)[13][14], das mit Lithiumaluminiumhydrid (LiAlH4) zu Pyrrolizidin reduziert wird (Ausbeute 73 %).[1]
Die Beobachtung transannularer Wechselwirkungen in so genannten mittleren Ringen (mit 7 bis 14 Ringgliedern) legte die Vermutung nahe, dass 1-Azabicyclo[3.3.0]octan aus der Zwischenstufe 1-Benzyl-1-azacyclooctan-5-on erhalten werden kann. Das durch Dieckmann-Kondensation des aus Benzylamin und 4-Iodbuttersäureethylester gebildeten Diesters zugängliche N-geschützte Azacyclooctanon (N-Benzylazocan-5-on) cyclisiert z. B. unter Einwirkung von Perchlorsäure HClO4 zum N-geschützten 8-Hydroxypyrrolizidin, aus dem durch Hydrierung die Benzylgruppe abgespalten wird und Pyrrolizidin-perchlorat bzw. Pyrrolizidin entsteht.[15]
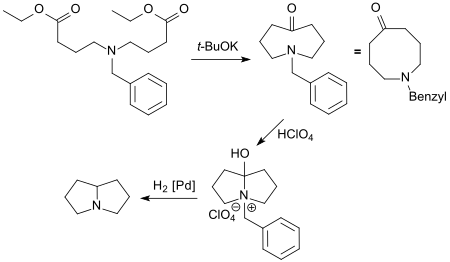
Das statt der Benzyl- mit der Boc-Schutzgruppe geschützte Azacyclooctanon (N-Boc-azocan-5-on)[16] kann ebenfalls leicht in Pyrrolizidin überführt werden.
Einen alternativen Zugang zu unsubstituierten Pyrrolizinen, Dihydropyrrolizinen und zu Pyrrolizidin eröffnet Pyrrol-2-carboxaldehyd, der mit Vinyltriphenylphosphoniumbromid[17] in Gegenwart von Natriumhydrid NaH zu 3H-Pyrrolizin (A) reagiert, das in Ethanol gelöst an einem Rhodium-Kontakt zu 1-Azabicyclo[3.3.0]octan (B) hydriert werden kann (Ausbeute 83 %).[3]
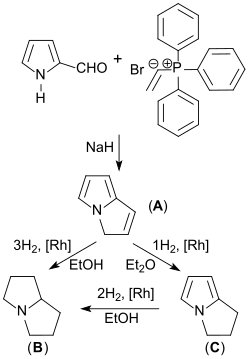
In weniger polarem Diethylether entsteht bei der Hydrierung 1,2-Dihydro-3H-pyrrolizin (C) (81 % Ausbeute).
Eine industrielle Synthese in großtechnischem Maßstab verwendet den preisgünstigen Ausgangsstoff Bernsteinsäureanhydrid, der beim Erhitzen auf 250 °C Kohlendioxid abspaltet und das so genannte Spirodilacton (γ-Ketopimelinsäuredilacton bzw. 1,6-Dioxaspiro[4.4]nonan-2,7-dion[18]) bildet (Ausbeute 84 %).

Das Spirodilacton wird an einem Cobalt-Kupfer-Mangan-Phosphorsäure-Kontakt mit Ammoniak und Wasserstoff bei hoher Temperatur und Druck zum Pyrrolizidin umgesetzt (Ausbeute 78 %).[5]
Eigenschaften
Pyrrolizidin wird als piperidinartig riechende Flüssigkeit beschrieben, die leicht am C-Atom in 8-Stellung und am N-Atom in 4-Stellung (unter Bildung von N-Oxiden) angegriffen wird. Wegen der Instabilität des freien tertiären Amins unter Umgebungsbedingungen und der hohen Hygroskopie des Perchlorats wird Pyrrolizidin meist in das in gelben Blättchen gut kristallisierende und bei 258–260 °C unter Zersetzung schmelzende Pikrat überführt.
Anwendungen
3,5-Dioxopyrrolizidin als Vorstufe des Pyrrolizidins ist strukturell dem Nootropikum Piracetam ähnlich und wurde unter dem Namen Rolziracetam u. a. als Wirkstoff gegen Demenz untersucht.[19] Von 1-Azabicyclo[3.3.0]octan abgeleitete Piracetamanaloga zeigten in Tierexperimenten eine verbesserte Hirnfunktion.[20]
Das Pyrrolizidinmotiv findet sich auch in Mitomycinen, wie z. B. Mitomycin C, das sowohl antibiotisch als auch zytostatisch aktiv ist.
Die in den Pflanzenwurzeln aus der Aminosäure L-Arginin über L-Ornithin, Putrescin und Spermidin ablaufende Biosynthese von Pyrrolizidinalkaloiden (PA) erzeugt eine große Molekülvielfalt mit derzeit mehr als 660 bekannten PA.[21][22] Diese sekundären Pflanzenmetabolite sind meist einfache Mono- oder Diester und cyclische Diester der Necinbase 1-Hydroxymethylpyrrolizidin bzw. des 1,2-ungesättigten Diols Retronecin, und deren N-Oxide. Pyrrolizidinalkaloide mit einer gesättigten Necinbase sind ungiftig, während ungesättigte und mit mindestens einer verzweigten C5-Carbonsäure veresterte PA in der Regel hepatotoxisch, mutagen und karzinogen wirksam sind.[23][24][25]
Einzelnachweise
- Fritz Micheel, Hans Albers: Synthesen von Pyrrolizidinderivaten (II. Mitteilung). In: Justus Liebigs Ann. Chem. Band 581, Nr. 1, 1953, S. 225–237, doi:10.1002/jlac.19535810124.
- Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 164.
- E.E. Schweizer, K.K. Light: Reactions of phosphorus compounds. IV. Preparation of 3H-pyrrolizine, 1,2-dihydro-3-H-pyrrolizine, and pyrrolizidine. In: J. Amer. Chem. Soc. Band 86, Nr. 14, 1964, S. 2963, doi:10.1021/ja01068a059.
- N.J. Leonard, W.E. Goode: Reductive cyclization. A general method for the synthesis of 1-azabicyclo compounds. In: J. Amer. Chem. Soc. Band 72, Nr. 12, 1950, S. 5404–5407, doi:10.1021/ja01168a010.
- Patent DE2136886: Verfahren zur Herstellung von Pyrrolizidinen. Angemeldet am 23. Juli 1971, veröffentlicht am 1. Februar 1973, Anmelder: BASF AG, Erfinder: W. Mesch, D. Voges, S. Winderl.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- T. Hartmann, H. Sander, R. Adolph, G. Toppel: Metabolic links between the biosynthesis of pyrrolizidine alkaloids and polyamines in root cultures of Senecio vulgaris. In: Planta. Band 175, Nr. 1, 1988, S. 82–90, doi:10.1007/BF00402884.
- Patent US2342119: Esters of nitro-fatty acids. Angemeldet am 16. Juli 1941, veröffentlicht am 22. Februar 1944, Anmelder: The Resinous Products & Chemicals Co., Erfinder: H.A. Bruson.
- N.J. Leonard, L.R. Hruda, F.W. Long: The synthesis of pyrrolizidines. In: J. Amer. Chem. Soc. Band 69, Nr. 3, 1947, S. 690–692, doi:10.1021/ja01195a067.
- Externe Identifikatoren von bzw. Datenbank-Links zu Diethyl-4-oxopimelat: CAS-Nummer: 6317-49-3, EG-Nummer: 228-657-0, ECHA-InfoCard: 100.026.052, PubChem: 80592, Wikidata: Q72462066.
- S. Rajagopalan, P.V.A. Raman: Furylacrylic acid In: Organic Syntheses. 25, 1945, S. 41, doi:10.15227/orgsyn.025.0041; Coll. Vol. 3, 1955, S. 425 (PDF).
- W.S. Emerson, R.I. Longley, Jr.: Diethyl γ-oxopimelate [Heptanedioic acid, 4-oxo-, diethyl ester] In: Organic Syntheses. 33, 1953, S. 25, doi:10.15227/orgsyn.033.0025; Coll. Vol. 4, 1963, S. 302 (PDF).
- Externe Identifikatoren von bzw. Datenbank-Links zu Rolziracetam: CAS-Nummer: 18356-28-0, PubChem: 71893, ChemSpider: 64906, Wikidata: Q7361449.
- F. Micheel, Wilhelm Flitsch: Eine einfache Synthese des 3,4-Dioxo-pyrrolizidins (Pyrrolizidinderivate III.). In: Chem. Ber. Band 88, Nr. 4, 1955, S. 509–510, doi:10.1002/cber.19550880410.
- N.J. Leonard, T. Sato: A transannular route for stereospecific synthesis. (±)-Isoretronecanol. In: J. Org. Chem. Band 34, Nr. 4, 1969, S. 1066–1070, doi:10.1021/jo01256a064.
- M. Morales-Chamorro, A. Vázquez: A facile synthesis of N-Boc-azocan-5-one. In: Synthesis. Band 51, 2019, S. 842–847, doi:10.1055/s-0037-1611018.
- E.E. Schweizer, R.D. Bach: Vinyl triphenylphosphonium bromide In: Organic Syntheses. 48, 1968, S. 129, doi:10.15227/orgsyn.048.0129; Coll. Vol. 5, 1973, S. 1145 (PDF).
- Externe Identifikatoren von bzw. Datenbank-Links zu 1,6-Dioxaspiro[4.4]nonan-2,7-dion: CAS-Nummer: 3505-67-7, EG-Nummer: 222-499-6, ECHA-InfoCard: 100.020.455, PubChem: 77041, Wikidata: Q83060361.
- U. Schindler: Pre-clinical evaluation of cognition enhancing drugs. In: Prog. Neuropsychopharmacol. Biol Psychiatry. Band 13, 1989, S. S99–S115, doi:10.1016/0278-5846(89)90114-0.
- M. Oka, Y. Matsumoto, K. Hirooka, T. Suzuki: Synthesis of 1-azabicyclo[3.3.0]octane derivatives and their effects as piracetam-like nootropics. In: Chem. Pharm. Bull. Band 48, Nr. 8, 2000, S. 1121–1124, doi:10.1248/cpb.48.1121.
- R. Moreira, D.M. Pereira, P. Valentão, P.B. Andrade: Pyrrolizidine Alkaloids: Chemistry, Pharmacology, Toxicology and Food Safety. In: Int. J. Mol. Sci. Band 19, Nr. 6, 2018, S. 1668, doi:10.3390/ijms19061668.
- S. Schramm, N. Köhler, W. Rozhon: Pyrrolizidine Alkaloids: Biosynthesis, Biological Activities and Occurrence in Crop Plants. In: Molecules. Band 24, Nr. 3, 2019, S. 498, doi:10.3390/molecules24030498.
- M. Lechtenberg, A. Hensel, B. Steinhoff: Phytoforschung: Hepatotoxisch und karzinogen – Pyrrolizidinalkaloide in Arznei- und Lebensmitteln sorgen für Probleme. In: DAZ. Band 31, 2017, S. 32 (deutsche-apotheker-zeitung.de).
- F. Partosch, R. Stahlmann: Toxikologie: Die Struktur macht das Gift – Lässt sich die Hepatotoxizität der Pyrrolizidinalkaloide am Computer voraussagen? In: DAZ. Band 14, 2018, S. 52 (deutsche-apotheker-zeitung.de).
- F. Kaltner, V. Kukula, C. Gottschalk: Screening of food supplements for toxic pyrrolizidine alkaloids. In: J. Consum. Prot. Food Saf. Band 15, 2020, S. 237–243, doi:10.1007/s-00003-020-01296-9.