Acrylsäuremethylester
Acrylsäuremethylester, häufig auch Methylacrylat genannt, ist eine chemische Verbindung aus der Gruppe der Acrylsäureester und damit auch der Carbonsäureester. Sie liegt in Form einer farblosen, stechend riechenden Flüssigkeit vor.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
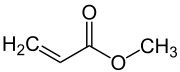 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Acrylsäuremethylester | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H6O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, stechend riechende, flüchtige, leichtentzündliche Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 86,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,95 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
80 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
mäßig in Wasser (52 g·l−1 bei 25 °C)[1] | ||||||||||||||||||
| Brechungsindex |
1,3984[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−362,2 kJ/mol[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Herstellung
Acrylsäuremethylester kann durch Debromierung von 2,3-Dibrompropansäuremethylester mit Zink und Schwefelsäure hergestellt werden.[6]
Bei der Pyrolyse von Milchsäuremethylester in Gegenwart von Ethenon (Keten) entsteht in guter Ausbeute Methylacrylat.[7] Milchsäuremethylester findet in jüngerer Zeit Aufmerksamkeit als chemische Verbindung aus nachwachsenden Rohstoffen (englisch „green chemical“). Ein neueres Patent[8] beschreibt die Pyrolyse von Methyllactat an Zeolithen, bei der in 93%iger Ausbeute Methylacrylat entsteht.
Die von Walter Reppe gefundene Nickeltetracarbonyl-katalysierte Hydrocarboxylierung von Acetylen mit Kohlenmonoxid in Anwesenheit von Methanol liefert ebenfalls Methylacrylat.[9] In der Patentliteratur[10] ist ein einstufiger Syntheseweg zu Methylacrylat über Oxidation von Propen bzw. Acrolein mit Sauerstoff in der Dampfphase in Gegenwart von Methanol beschrieben. Die Umsetzung von Methylformiat mit Acetylen in Gegenwart von Übergangsmetallkatalysatoren führt ebenfalls zu Methylacrylat.[11] Die Alkoholyse von Propiolacton mit Methanol gehört ebenso wie die Methanolyse von Acrylnitril über das intermediär entstehende Acrylamidsulfat[12] zu den veralteten Verfahren zur Herstellung von Acrylsäuremethylester.
Die Verfügbarkeit von preisgünstiger Acrylsäure nach dem Verfahren der Propenoxidation hat die direkte Veresterung mit Methanol unter saurer Katalyse (Schwefelsäure, p-Toluolsulfonsäure, saure Ionenaustauscher[13]) zur großtechnisch ausschließlich genutzten Standardreaktion werden lassen.
Eigenschaften
Acrylsäuremethylester ist eine farblose, stechend riechende, flüchtige, leichtentzündliche Flüssigkeit, die bei Normaldruck bei 80 °C siedet.[1] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,32327, B = 1338,663 und C = −43,516 im Temperaturbereich von 229,5 bis 353,3 K.[14] Die Dämpfe sind dreimal so schwer wie Luft. Acrylsäuremethylester neigt zur spontanen Polymerisation, insbesondere unter Lichteinfluss oder bei erhöhten Temperaturen. Die Polymerisationswärme beträgt −80 kJ·mol−1 bzw. −930 kJ·kg−1.[15] Als Stabilisator wird deshalb 10–20 ppm Hydrochinonmonomethylether (MEHQ) zugesetzt. Bei Lagerung in Gegenwart von Sauerstoff und unterhalb 35 °C beträgt die Lagerdauer mindestens ein Jahr.[16]
Sicherheitstechnische Kenngrößen
Acrylsäuremethylester bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −3 °C.[1][17] Der Explosionsbereich liegt zwischen 1,95 Vol.‑% (71 g/m3) als untere Explosionsgrenze (UEG) und 16,3 Vol.‑% (581 g/m3) als obere Explosionsgrenze (OEG).[1][17] Eine Korrelation mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von −5 °C).[1] Die Grenzspaltweite wurde mit 0,85 mm bestimmt.[1][17] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIB. Die Zündtemperatur beträgt 415 °C.[17][1] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
Acrylsäuremethylester ist nach Acrylsäurebutylester und Acrylsäureethylester mit der weltweiten Jahresproduktion von ca. 200.000 Tonnen pro Jahr[18] der drittwichtigste Acrylester.
Wie Acrylsäureethylester reagiert auch der Methylester unter Katalyse durch Lewis-Basen in einer Michael-Addition mit Aminen in hohen Ausbeuten zu β-Alanin-Derivaten, die bei Verwendung langkettiger Amine und nachfolgender Hydrolyse der Esterfunktion amphotere Tenside liefern.
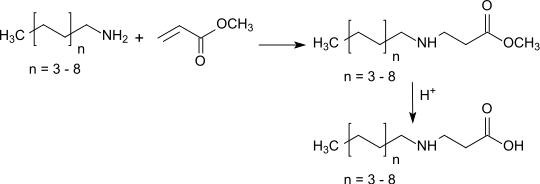
Acrylsäuremethylester dient in erheblichen Mengen über 50.000 Tonnen/Jahr zur Herstellung von 2-Dimethylaminoethylacrylat durch Umesterung mit Dimethylaminoethanol.[19]
Seine Einsatzbreite als Comonomer bei der Polymerisation mit einer Vielzahl von Acryl- und Vinylmonomeren ist weitgehend gleich mit der des Ethylacrylats.[20] Mit Acrylsäuremethylester als Comonomer werden härtere und sprödere Acryllacke erhalten als mit den homologen Acrylsäureestern. Copolymerisation von Methylacrylat mit Acrylnitril verbessert die Verarbeitbarkeit in der Schmelze zu Fasern, die als Vorstufen für Kohlenstofffasern („Carbonfasern“) interessant sein könnten.[21]
Acrylsäuremethylester wird zur Herstellung von Polyamidoamin-Dendrimeren (typischerweise durch eine Michael-Addition mit einem primären Amin) verwendet.
Sicherheitshinweise
In der Umwelt wird die Substanz leicht abgebaut und reichert sich nicht an. Wegen der augen-, haut- und schleimhautreizenden Eigenschaften und des unangenehm stechenden Geruchs muss Acrylsäuremethylester in geschlossenen Kompartimenten gehandhabt werden.
Weblinks
- Eintrag zu Methyl acrylate in der Spectral Database for Organic Compounds (SDBS) des National Institute of Advanced Industrial Science and Technology (AIST)
- Said Abbadi: Herstellung und Verwendung von Polymerperoxiden als Initiatoren der radikalischen Polymerisation von Methylmethacrylatsystemen. (PDF; 1,3 MB) Dissertation, Hamburg, 2003. urn:nbn:de:gbv:18-21304
Siehe auch
Einzelnachweise
- Eintrag zu Methylacrylat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. August 2017. (JavaScript erforderlich)
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- Eintrag zu Methyl acrylate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 96-33-3 bzw. Methylacrylat), abgerufen am 16. September 2019.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- F. Beilstein: Handbuch der organischen Chemie, 3. Auflage, 1. Band. Verlag Leopold Voss, 1893, S. 501. Volltext.
- Patent US2417748: Preparation of Methyl Acrylate. Veröffentlicht am 18. März 1947, Anmelder: Eastman Kodak Company, Erfinder: Hugh J. Hagemeyer.
- Patent US5250729: Process for preparing unsaturated carboxylic acid or ester thereof. Angemeldet am 4. Dezember 1989, veröffentlicht am 5. Oktober 1993, Anmelder: Mitsubishi Gas Chemical Company, Erfinder: Takafumi Abe, Shinichi Hieda.
- W. Reppe, Liebigs Ann. Chem., 582 (1), 116-132 (1953).
- Patent US3925463: Process for the Production of Methyl Acrylate. Veröffentlicht am 9. Dezember 1975, Anmelder: Societá Italiana Resine S.I.R., S.p.A., Erfinder: Natale Ferlazzo, Buzzi Gian Fausto, Ghirga Marcello.
- Patent US6022990: Method for synthesizing methyl acrylate. Veröffentlicht am 8. Februar 2000, Anmelder: Chengdu Institute of Organic Chemistry, Erfinder: Zhao-Tie Liu, Jia-Qi Zhang, Xian-Gui Yang.
- H.-J. Arpe, Industrielle Organische Chemie, 6. Aufl., Wiley-VCH Verlag, Weinheim, 2007, ISBN 978-3-527-31540-6.
- Esterification: Acrylate esters (MA, EA, BA, MMA, 2-EHA) (englisch) amberlyst.com. Abgerufen am 21. Februar 2013.
- Stull, D.R.: Vapor Pressure of Pure Substances – Organic Compounds in Ind. Eng. Chem. 39 (1947) 517–540, doi:10.1021/ie50448a022.
- Berufsgenossenschaft Rohstoffe und chemische Industrie, Merkblatt R 008 Polyreaktionen und polymerisationsfähige Systeme, Ausgabe 05/2015, ISBN 978-3-86825-069-5
- BASF AG, Technical Data Sheet, Methyl acrylate, August 2003.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- CEH Marketing Research Report Acrylic Acid and Esters, SRI Consulting, Juli 2007.
- Patent WO2010136696: Composition Including Dialkyl Tin Oxide and Use Thereof as a Transesterification Catalyst for the Synthesis of (meth)acrylic Esters. Veröffentlicht am 2. Dezember 2010, Anmelder: Arkema France, Erfinder: Jean-Michel Paul, Boris Tonnelier, Francis Augustin.
- DOW Methyl acrylate, Product Safety Assessment.
- V. A. Bhanu et al.: Synthesis and characterization of acrylonitrile methyl acrylate statistical copolymers as melt processable carbon fiber precursors. In: Polymer. Band 43, Nr. 18, August 2002, S. 4841–4850, doi:10.1016/S0032-3861(02)00330-0 (englisch, PDF).

