Anthrachinonfarbstoffe
Anthrachinonfarbstoffe sind eine umfangreiche Gruppe von Farbstoffen, mit Anthrachinon als gemeinsamem Strukturelement. Anthrachinon selbst ist farblos – durch Einführung von Elektronendonator-Gruppen, wie z. B. Hydroxy- oder Aminogruppen in die 1-, 4-, 5- oder 8-Position erhält man rote bis blaue Farbstoffe.[1] Anthrachinonfarbstoffe sind strukturell mit den indigoiden Farbstoffen verwandt und werden mit diesen gemeinsam in die Gruppe der Carbonylfarbstoffe eingeordnet.[2]

Vertreter dieser Farbstoffgruppe findet man sowohl bei den Naturfarbstoffen, als auch bei den synthetischen Farbstoffen. Anthrachinonfarbstoffe sind bei den Beizen- und Küpenfarbstoffen, aber auch bei den Reaktiv- und Dispersionsfarbstoffen vertreten. Sie zeichnen sich durch eine sehr gute Lichtechtheit aus.[3]
Natürliche Anthrachinonfarbstoffe
Einer der wichtigsten Anthrachinonfarbstoffe pflanzlichen Ursprungs ist Alizarin, das aus dem Färberkrapp (Rubia tinctorum) gewonnen wird. Alizarin ist der Namensgeber für eine Reihe strukturell verwandter Farbstoffe, die Alizarinfarbstoffe (mitunter synonym für die Anthrachinonfarbstoffe verwendet). Es war der erste natürliche Farbstoff, für den bereits 1869 eine industrielle Synthese entwickelt wurde.
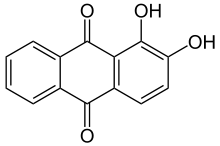
Zu den Anthrachinonfarbstoffen gehören die aus Schildläusen gewonnenen Insektenfarbstoffe Karminsäure, Kermessäure und die Laccainsäuren. Der Farbstoff Karmin mit dem Hauptbestandteil Karminsäure wird beispielsweise als zugelassener Lebensmittelfarbstoff E 120 verwendet.
Synthetische Anthrachinonfarbstoffe
Die Synthese der meisten Anthrachinonfarbstoffe geht von Anthrachinonsulfonsäure (2) oder Nitroanthrachinon (3) aus, die man durch Sulfonierung, bzw. Nitrierung von Anthrachinon (1) erhält.

Die Sulfonierung in der α-Position ist reversibel und sowohl die Sulfonsäuregruppen, als auch die Nitrogruppen lassen sich relativ einfach durch Amino-, Alkylamino-, Hydroxy- und Alkoxy-Gruppen austauschen. Aminoanthrachinon (4) ist durch Umsetzung von Anthrachinonsulfonsäure mit Ammoniak oder durch Reduktion von Nitroanthrachinon zugänglich.[4]
Ein wichtiges Zwischenprodukt für viele saure Anthrachinonfarbstoffe ist die Bromaminsäure (1-Amino-4-bromanthrachinon-2-sulfonsäure) (6), die ausgehend von 1-Aminoanthrachinon (4), über eine Sulfonierung mit Chlorsulfonsäure und anschließender Bromierung zugänglich ist.
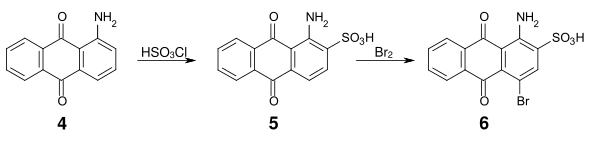
Durch Austausch des Bromsubstituenten durch ein aliphatisches oder aromatisches Amin erhält man brillante blaue Farbstoffe.[5] Beispielsweise lässt sich Bromaminsäure mit 3-(2-Hydroxyethylsulfonyl)-anilin (7) zu dem brillantblauen Farbstoff (8) (Oxysulfonblau) kondensieren, aus dem man nach Veresterung mit Schwefelsäure den Reaktivfarbstoff C.I. Reactive Blue 19 erhält.
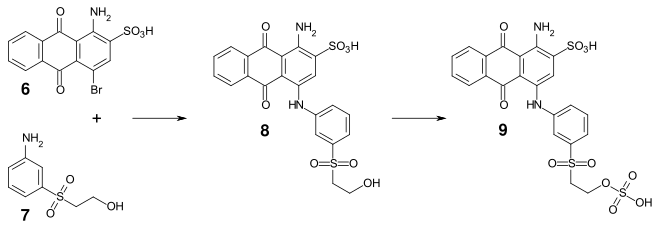
Reactive Blue 19 ist einer der ältesten, bereits 1949 patentierten[6] und nach wie vor wichtigsten Reaktivfarbstoffe.[7]
Der erste synthetische Küpenfarbstoff auf Anthrachinon-Basis war Indanthron (C.I. Vat Blue 4) – dessen Synthese 1901 durch René Bohn entwickelt wurde:
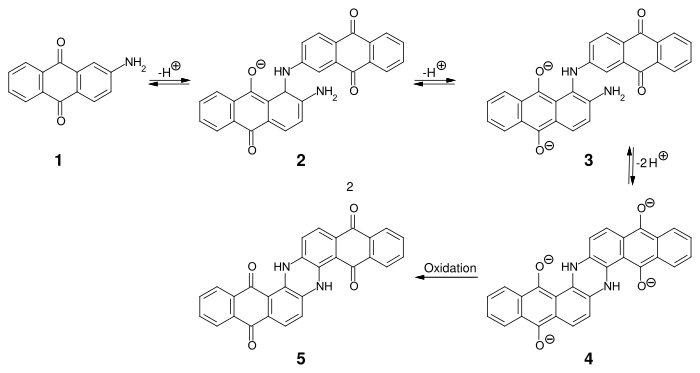
Durch Dimerisierung von 2-Aminoanthrachinon (1) unter stark alkalischen Bedingungen bei 220–235 °C erhält man in zwei Schritten die Zwischenstufe 3, die intramolekular cyclisiert und zum Indanthron 5 oxidiert wird.[8]
Einzelnachweise
- Klaus Hunger (Hrsg.): Industrial Dyes: Chemistry, Properties, Applications. WILEY-VCH Verlag, Weinheim 2003, ISBN 978-3-662-01950-4, S. 35 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- Heinrich Zollinger: Color Chemistry: Syntheses, Properties, and Applications of Organic Dyes and Pigments. 3. Auflage. WILEY-VCH Verlag, Weinheim 2003, ISBN 3-906390-23-3, S. 255 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Anthrachinon-Farbstoffe. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Dezember 2018.
- Klaus Hunger (Hrsg.): Industrial Dyes: Chemistry, Properties, Applications. WILEY-VCH Verlag, Weinheim 2003, ISBN 978-3-662-01950-4, S. 200 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- Heinz-Gerhard Franck, Jürgen W. Stadelhofer: Industrielle Aromatenchemie: Rohstoffe · Verfahren · Produkte. Springer Verlag, Berlin, Heidelberg 1978, ISBN 978-3-662-07876-1, S. 365 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- Patent DE965902: Verfahren zum Fixieren wasserloeslicher organischer Verbindungen auf Unterlagen faseriger Struktur. Angemeldet am 19. Juli 1949, veröffentlicht am 19. September 1957, Anmelder: Hoechst AG, Erfinder: Johannes Heyna, Willy Schumacher.
- Patent DE4422160: Verfahren zur Herstellung von C.I. Reactive Blue 19. Angemeldet am 24. Juni 1994, veröffentlicht am 1. April 1996, Anmelder: Hoechst AG, Erfinder: Andreas Von Der Eltz.
- Heinrich Zollinger: Color Chemistry: Syntheses, Properties, and Applications of Organic Dyes and Pigments. 3. Auflage. WILEY-VCH Verlag, Weinheim 2003, ISBN 3-906390-23-3, S. 289 (eingeschränkte Vorschau in der Google-Buchsuche).