Alkydharze
Alkydharze sind synthetische hydrophobe Polymere, die durch Kondensation mehrwertiger Alkohole mit mehrprotonigen Säuren unter Zusatz von Ölen bzw. Fettsäuren (zur Modifizierung der Eigenschaften des Harzes) entstehen.[1] Chemisch gehören sie zu den Polyestern und sind verwandt mit den Polyesterharzen, zu deren Herstellung jedoch keine langkettigen Fettsäuren eingesetzt werden.
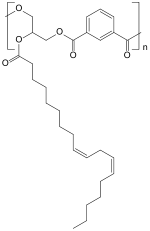
Als mehrwertiger Alkohol wird v. a. Glycerin, als mehrprotonige Säure überwiegend Phthalsäure (oder deren Anhydrid) eingesetzt;[2] die abgebildete Struktur zeigt allerdings einen Polyester aus Glycerin mit Isophthalsäure unter Einbau von Linolsäure.[3]
Der Begriff Alkyd wurde bereits 1927 durch R. H. Kienle eingeführt und setzt sich zusammen aus Alkohol und acid, dem englischen Begriff für Säure. Zur Abgrenzung zu den bis dato gebräuchlichen Ölfarben auf Basis von härtenden Ölen und Naturharzen bezeichnet man Alkydharzlacke auch als Kunstharzfarben.
Alkydharze unterscheidet man nach der Höhe des Ölgehaltes[4]
- <40 %: kurzölige Alkydharze
- 40 bis 60 %: mittelölige Alkydharze
- >60 %: langölige Alkydharze
sowie nach dem Trocknungsverhalten[5]
- lufttrocknende Alkydharze
- ofentrocknende Alkydharze
- nichttrocknende Alkydharze
Lufttrocknende Alkydharze polymerisieren unter dem Einfluss von Sauerstoff über die Doppelbindungen der ungesättigten Fettsäurereste. Das Trocknungsverhalten hängt sowohl vom Anteil als auch von der Art der in das Polymer eingebauten Fettsäuren ab. Besonders reaktiv sind mehrfach ungesättigte Fettsäuren, wie die in der Formel gezeigte Linolsäure oder besonders die α-Linolensäure. Einfach ungesättigte Fettsäuren, wie die Ölsäure härten nur sehr langsam. Zur Beschleunigung der Trocknung werden üblicherweise Katalysatoren (sogenannte Sikkative) zugesetzt; dies sind meist Metallseifen von Cobalt oder Mangan.[4]
Ofentrocknende Alkydharze enthalten geringere Anteile mehrfach ungesättigter Fettsäuren, sodass sie bei Raumtemperatur nur ungenügend härten; sie werden als Komponenten in ofentrocknenden Lacken (Einbrennlacken), meist in Kombination mit anderen Kunstharzen, verwendet.[4]
Nichttrocknende Alkydharze werden als polymere Weichmacher, z. B. in Nitrozelluloselacken (Nitrokombilacke) eingesetzt.[5]
Modifizierte Alkydharze
Alkydharze werden häufig zur Verbesserung der Eigenschaften modifiziert, so z. B. mit Isocyanaten (Urethanalkyde), mit Styrol (styrolisierte Alkydharze)[4] oder mit Acrylsäure-bzw. Methacrylsäureestern (acrylierte Alkydharze).[6] Im Folgenden soll die Modifizierung von Alkydharzen ausführlich dargestellt werden.[7]
| Art der Modifizierung | Resultierende Eigenschaftsverbesserung |
|---|---|
| Polystyrol / Polyacrylsäureester |
|
| Resole (PF) |
|
| Epoxidharze |
|
| Silikone |
|
| Isocyanate |
|
| Polyamide |
|
Styrol- / Acrylestermodifizierung
Zur Modifizierung der Alkydharze mit Styrol sind zunächst mehrfach ungesättigte Fettsäuren im chemischen Aufbau der Alkydharze nötig. Diese reagieren in Anwesenheit von Peroxiden als Initiatoren (Bsp. Di-tert.-Butylperoxid), bei ca. 140–170 °C unter einer radikalischen Polymerisation. Dabei entstehen teilweise Polymerbrücken zwischen den Fettsäuremolekülen und Verzweigungen. Die dadurch entstehenden höheren Molmassen führen zu besseren Beständigkeiten. Die hohe Tg des Copolymerisats erhöht die Beständigkeiten ebenfalls und sorgt zusätzlich zu einer schnelleren Antrocknung. Dadurch, dass die Doppelbindungen der Fettsäuren mit dem Copolymerisat reagieren sinkt die Vergilbungsneigung, allerdings wird die Durchtrocknung in Lacken ebenfalls verschlechtert.
Modifizierung mit Epoxidharzen
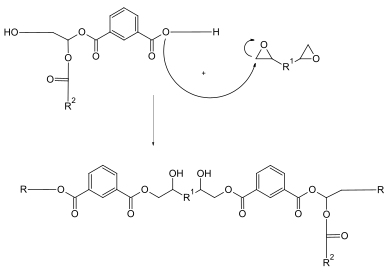
Hierzu werden Alkydharze benötigt, die noch eine recht hohe Säurezahl aufweisen. Durch Umsetzung der Carboxygruppe mit Epoxiden entstehen Epoxidharzmodifizierte Alkydharze. Das Epoxidharz hat dabei die Funktion eines oligomeren Alkoholderivats. Durch die Modifizierung wird vor allem eine bessere Haftung auf Metall und ein gesteigerter Korrosionsschutz erreicht. Im Folgenden wird die Reaktion vereinfacht dargestellt. Das Grundgerüst des Epoxidharzes R kann aus Bisphenol A und Epichlorhydrin aufgebaut sein. Als R2 im Alkydharzgrundgerüst kommen mehrfach ungesättigte C18-Fettsäuren in Frage.
Modifizierung mit Silikonen
Hier kommen oligomere Siloxane zum Einsatz, die in das Grundgerüst der Alkydharze eingebaut werden. Durch die hydrophoben Eigenschaften der Siloxane steigt die Wasserfestigkeit. Zusätzlich wird auch die Witterungs- und Chemikalienbeständigkeit verbessert. Da Silikone über eine hohe Temperaturbeständigkeit verfügen wird diese ebenfalls verbessert.
Modifizierung mit Isocyanaten
Werden Anteile von Phthalsäureanhydrid durch Diisocyanate (z. B. TDI) ersetzt, erhält man eine Urethanmodifizierung. Hierzu werden zuerst Alkydharze mit geringer Molmasse und hohem OH-Gehalt hergestellt. Dann folgt die Umsetzung mit einem Diisocyanat. Je nach Gehalt an Urethangruppen kann eine hohe Härte bei gleichzeitiger Elastizität erreicht werden. Wegen des geringeren Anteils an Estergruppen werden die chemischen Beständigkeiten, vor allem die Alkalibeständigkeit verbessert. Die Wetterbeständigkeit ist davon abhängig, ob ein aromatisches oder aliphatisches Isocyanat eingesetzt wird. Im Folgenden wird ein Reaktionsbeispiel zur Herstellung eines urethanmodifizierten Alkydharzes dargestellt. Das Isocyanat (hier TDI) reagiert mit den OH-Gruppen des Alkydharzes. Um OH-funktionelle Produkte zu erhalten, müssen die OH-Gruppen im Überschuss vorliegen.
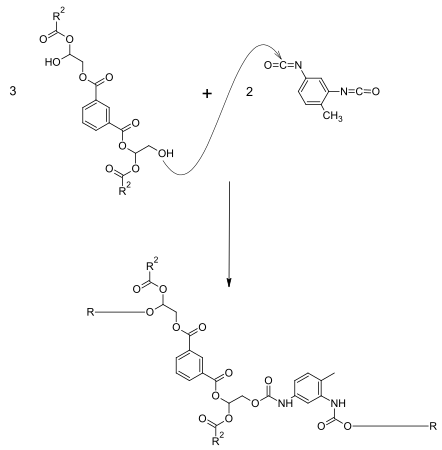
Wird Phthalsäureanhydrid komplett durch das Diisocyanat ausgetauscht, werden sogenannten Urethanöle erhalten.
Modifizierung mit Polyamiden
Alkydharze zeigen oft eine leichte, zeitlich unabhängige, Scherverdünnung. Diese Strukturviskosität kommt durch die Wechselwirkungen zwischen den gelösten Makromolekülen und wird durch eine höhere Lösungskonzentration verstärkt. Ein thixotropes Verhalten erreicht man, wenn man Segmente einbaut, die untereinander eine starke Assoziationsneigung haben, im gelösten Lösungsmittel aber unlöslich sind. Es bilden sich starke Netzwerke aus, die durch Scherung zerstört werden und sich erst nach einer gewissen Zeit wieder aufbauen. Die Thixotropie nimmt mit Zugabe polarer Lösemittel wieder ab, da die Wechselwirkungen zwischen den Assoziativ wirkenden Gruppen unterbrochen werden.
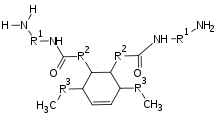
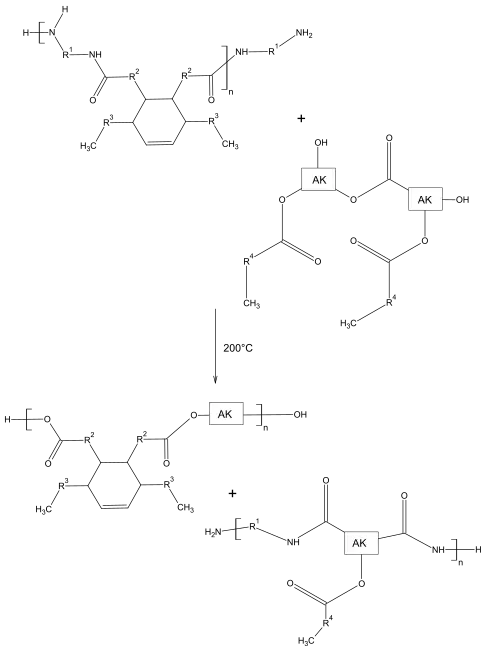
Thixotrope Alkydharze entstehen durch die Umsetzung mit Polyamiden. Besonders geeignet sind Polyamide aus Polyaminen und Dimerfettsäuren. Im Gegensatz zu vielen Polyamiden sind diese nicht kristallin und in unpolaren Lösungsmitteln nur teilweise löslich.
Bei ca. 200 °C kommt es zusammen mit einem Alkydharz zu Umamidierungen. Die am Alkydharz neu entstandenen Amid-Gruppen sorgen für die Ausbildung der Netzwerke. Im Folgenden wird die Reaktion schematisch dargestellt. Als Reste kommen C18 Fettsäuren in Frage. Das Produkt ist in der Lage über Wasserstoffbrückenbindungen Netzwerke auszubilden.
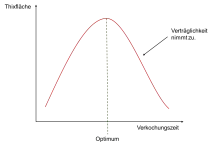
Die Verkochungszeit ist von entscheidender Bedeutung für die spätere Thixotropie des Bindemittels. Ist diese zu gering, ist der Umsatz noch zu niedrig und es kann keine Thixotropie ausgebildet werden. Bei zu langer Verkochungszeit hätte man eine vollständig verträgliche Lösung, ebenfalls ohne thixotropes Verhalten.
Als Hinweis für die optimale Verkochungszeit kann der Klarpunkt dienen. Durch die Unverträglichkeit zwischen Polyamid und Alkydharz trübt sich die Lösung. Diese Trübung verschwindet über die Zeit und die Reaktion kann dann beendet werden. Zusätzlich können über die Verkochungszeit mehrere Proben gezogen und das rheologische Verhalten bestimmt werden. Die Dauer bis zur maximalen Thixotropie kann hierauf folgend als Richtlinie für den Herstellungsprozess dienen.
Verwendung
Alkydharze werden vor allem verwendet als:
- Alkydharzlack
- Spachtelmassen
- Zusatzstoffe (Hilfsstoffe)
Einzelnachweise
- Dieter Stoye, Werner Freitag: Lackharze. Carl Hanser Verlag, 1996, ISBN 3-446-17475-3.
- A. Spyros: Characterization of Unsaturated Polyester and Alkyd Resins Using One- and Two-Dimensional NMR Spectroscopy. In: Journal of Applied Polymer Science 88, 2003, S. 1881–1888. ISSN 0021-8995.
- T. Nagata: Cooking Schedule of Alkyd Resin Preparation. Part II. Effect of Cooking Schedule on Molecular Weight Distribution of Alkyd Resin. In: Journal of Applied Polymer Science 13, 1969, S. 2601–2619. ISSN 0021-8995.
- Eintrag zu Alkydharze. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2014.
- Kittel, Lehrbuch der Lacke und Beschichtungen, 2. Aufl., Band 2: Bindemittel für lösemittelhaltige und lösemittelfreie Systeme, Hrsg. Walter Krauß, s. Hirzel Verlag 1998, ISBN 3-7776-0886-6.
- Goldschmidt und Streitberger: Lackiertechnik, 2002.
- Poth, Ulrich-: Polyester und Alkydharze : Grundlagen und Anwendungen. 2., überarb. Auflage. Vincentz Network, Hannover 2014, ISBN 978-3-86630-662-2, S. 197–204.