Anthrachinone
Die Anthrachinone sind chemischen Verbindungen, die sich vom Anthrachinon ableiten. Zu ihnen gehören sowohl Naturstoffe pflanzlichen und tierischen Ursprungs, als auch synthetische Anthrachinonderivate, die insbesondere als Farbstoffe eingesetzt werden. Einige Pflanzenarten finden aufgrund ihres Anthrachinongehaltes medizinische Verwendung.
Natürliche Anthrachinone
Vorkommen
In der Natur werden Anthrachinone von Pilzen und Samenpflanzen gebildet und kommen als Farbstoffe bei einigen pflanzensaugenden Insekten vor. So ist die Karminsäure der Farbstoff der Cochenilleschildlaus (Dactylopius coccus) und Lecanium ilicis, die auf Ilex-Arten saugt, enthält Kermesinsäure.[1]
Strukturen
In den meisten Anthrachinonen ist das Anthracen-Grundgerüst mit einer oder mehreren Hydroxygruppen substituiert. Anthrachinone können leicht und reversibel zu Anthronen und Anthranolen reduziert werden.[2]
Anthron-Derivate verfügen an der Position 10 über eine aktivierte Methylen-Gruppe und können an dieser Stelle C-Glycoside bilden (z. B. Aloin bzw. Barbaloin). Die meisten Anthrachinone und Anthrone bilden allerdings O-Glycoside. Häufig sind zwei Anthrachinone oder Anthrone über C-C-Verbindungen verbunden, etwa bei Hypericin.[2]
| Anthrachinon bzw. Anthrachinonderivat | Grundstruktur | R1 | R2 | R3 | R4 | R5 | R6 | R7 | R8 |
|---|---|---|---|---|---|---|---|---|---|
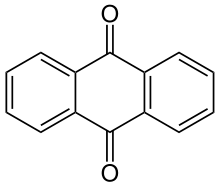
| Anthrachinon | 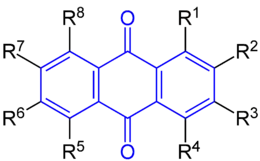 Die Stoffgruppe der Anthrachinone mit dem blau markierten Grundgerüst des 9,10-Anthrachinons (R1 bis R8= H). |
–H | –H | –H | –H | –H | –H | –H | –H |
| Alizarin | –OH | –OH | –H | –H | –H | –H | –H | –H | |
| Chinizarin | –OH | –H | –H | –OH | –H | –H | –H | –H | |
| Chrysazin | –OH | –H | –H | –H | –H | –H | –H | –OH | |
| Hystazarin | –H | –OH | –OH | –H | –H | –H | –H | –H | |
| Purpurin | –OH | –OH | –H | –OH | –H | –H | –H | –H | |
| Chrysophansäure | –OH | –H | –CH3 | –H | –H | –H | –H | –OH | |
| Chinalizarin | –OH | –OH | –H | –H | –OH | –H | –H | –OH | |
| Flavopurpurin | –OH | –OH | –H | –H | –H | –OH | –H | –H | |
| Physcion | –OH | –H | –CH3 | –H | –H | –OCH3 | –H | –OH | |
| Anthrarufin | –OH | –H | –H | –H | –OH | –H | –H | –H |
Biosynthese
In den meisten Organismen werden die Anthrachinone über den Polyketid-Weg synthetisiert, sie sind demnach Octaketide. Ihre Biosynthese startet demnach mit Acetyl-Coenzym A. Diese Anthrachinone werden von Schimmelpilzen wie Aspergillus und Penicillium, von Flechten, Ständerpilzen, und Höheren Pflanzen, wie den Knöterichgewächsen und Kreuzdorngewächsen gebildet.[2]
Die Biosynthese erfolgt aus einem Acetyl-Coenzym A und sieben Malonyl-Coenzym A. Diese werden zu einer Octaoxosäure verbunden, die cyclisiert wird. Der daraus entstehende Anthron-Körper besitzt an Position 2 eine Carboxyl-Gruppe und an Position 3 eine Methyl-Gruppe. Erstere kann in Folge eliminiert werden, letztere zu einer CH2OH- oder Carboxygruppe oxidiert werden. Das Anthron kann leicht zum Anthrachinon oxidiert werden. Eine Dimerisierung erfolgt über Radikale, die durch Phenoloxidasen oder Peroxidasen gebildet werden.[2]
Anthrachinone können durch Spaltung des mittleren B-Ringes und weitere Reaktionen zu Xanthonen umgewandelt werden.[2]
Seltener werden Anthrachinone über den Shikimisäureweg gebildet. Die Biosynthese verläuft über Isochorisminsäure, 2-Succinylbenzoesäure, 1,4-Naphthohydrochinon-2-carboxylsäure und 3-Prenylnaphthohydrochinon-2-carboxylsäure. Sie teilen den Biosyntheseweg mit den Naphthochinonen und Phyllochinonen. Ein Beispiel ist Alizarin.[4]
Analytik
Die zuverlässige qualitative und quantitative Bestimmung der Anthrachinone in unterschiedlichen Untersuchungsmaterialien gelingt nach adäquater Probenvorbereitung durch die Kopplung der HPLC mit der Massenspektrometrie.[5][6][7]
Medizinische Nutzung
Anthrachinone und Anthrachinonderivate werden als Abführmittel eingesetzt. Medizinisch verwendet werden folgende anthrachinonhaltigen Pflanzen bzw. Pflanzenteile: Sennesblätter und -früchte, Faulbaumrinde, Cascararinde (Rhamnus purshiana), Rhabarberwurzel (Rheum palmatum und Rheum officinale) und Aloe (Aloe capensis und Aloe barbadensis). Sie verhindern die Resorption von Natrium aus dem Darmlumen und damit verbunden von Wasser, sie wirken also antiresorptiv. Darüber hinaus können sie den Einstrom von Flüssigkeit zusammen mit Natrium-, Kalium-, Calcium- und Chlorid-Ionen in den Darm auslösen, somit sekretagog wirken. Diese Wirkungen führen zu einem weicheren Faeces sowie zu einer zunehmenden Füllung des Dickdarms. Durch die Dehnung der Darmwand wird die Darmpassage beschleunigt und die Defäkation erleichtert. In der Droge liegen die Anthrachinone als Glycoside vor. Die Zucker werden erst im Dickdarm von Bakterien abgespalten, weshalb die Drogen ihre Wirkung auch erst hier entfalten. Die zuckerfreien Aglykone werden auch als Emodine bezeichnet. Sie werden durch die Darmbakterien zu den entsprechenden Anthronen und Anthranolen reduziert. Erst diese Substanzen sind die eigentlich wirksamen.[8]
Die Anthrachinone und ihre Derivate werden überwiegend mit dem Stuhl ausgeschieden. Nur rund 5 % werden resorbiert und mit dem Urin ausgeschieden, der durch sie dunkel gefärbt wird.[8]
Anthrachinone werden häufig in Form von Tees verabreicht, in Fertigarzneimitteln liegen häufig Trockenextrakte vor. Anthrachinone sind wie Diphenylmethanderivate nur bei schweren Formen der Verstopfung angezeigt. Eine Elektrolytverschiebung im Serum wurde bei chronischer Einnahme nicht beobachtet.[9]
Ökologische Bedeutung
In Pflanzen haben die Anthrachinone wahrscheinlich die Funktion als Repellent gegen mögliche Herbivoren. Hypericin ist eine photoaktive Substanz und wirkt als Repellent in Hypericum perforatum, desgleichen Fagopyrin in Buchweizen[10] (Fagopyrum exculentum). Physcion und verwandte Anthrachinone sind für die auffälligen Farben in den Fruchtkörpern von Pilzen, wie bspw. Dermocybe, verantwortlich.[2]
Synthetische Anthrachinone
Die wichtigsten synthetischen Anthrachinone gehören zu den Anthrachinonfarbstoffen, bzw. den entsprechenden Farbstoffzwischenprodukten.[11]
Darüber hinaus gibt es einige spezielle Anwendungen, wie z. B. die Verwendung von 2-Ethylanthrachinon als Photoinitiator[12] oder als Katalysator bei der Wasserstoffperoxid-Herstellung. Heute wird Wasserstoffperoxid überwiegend nach verschiedenen Varianten des Anthrachinon-Verfahrens (Riedl-Pfleiderer-Prozess) hergestellt.[13]
Einzelnachweise
- Dieter Schlee: Ökologische Biochemie. 2. Auflage. Gustav Fischer Verlag, Jena 1992, ISBN 3-334-60393-8, S. 355.
- Martin Luckner: Secondary Metabolism in Microorganisms, Plants and Animals. 3. Auflage. VEB Gustav Fischer Verlag, Jena 1990, ISBN 3-334-00322-1, S. 176–178.
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 1: A–Cl. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1979, ISBN 3-440-04511-0, S. 222–223.
- Martin Luckner: Secondary Metabolism in Microorganisms, Plants and Animals. 3. Auflage. VEB Gustav Fischer Verlag, Jena 1990, ISBN 3-334-00322-1, S. 329–330.
- S. Y. Wei, W. X. Yao, W. Y. Ji, J. Q. Wei, S. Q. Peng: Qualitative and quantitative analysis of anthraquinones in rhubarbs by high performance liquid chromatography with diode array detector and mass spectrometry. In: Food Chem. 141(3), 2013, S. 1710–1715. PMID 23870882
- S. Lee, S. G. Do, S. Y. Kim, J. Kim, Y. Jin, C. H. Lee: Mass spectrometry-based metabolite profiling and antioxidant activity of Aloe vera ( Aloe barbadensis Miller) in different growth stages. In: J Agric Food Chem. 60(45), 14. Nov 2012, S. 11222–11228. PMID 23050594
- Z. W. Zhu, J. Li, X. M. Gao, E. Amponsem, L. Y. Kang, L. M. Hu, B. L. Zhang, Y. X. Chang: Simultaneous determination of stilbenes, phenolic acids, flavonoids and anthraquinones in Radix polygoni multiflori by LC-MS/MS. In: J Pharm Biomed Anal. 62, 25. Mar 2012, S. 162–166. PMID 22296653
- H. Kilbinger: Pharmaka zur Beeinflussung der Funktionen von Magen, Dünn- und Dickdarm - Pharmakotherapie gastrointestinaler Erkrankungen. In: Klaus Aktories, Ulrich Förstermann, Franz Hofmann, Klaus Starke: Allgemeine und spezielle Pharmakologie und Toxikologie. 10. Auflage. Elsevier, München 2009, ISBN 978-3-437-42522-6, S. 571–573.
- AWMF Online: S2k-Leitlinie Chronische Obstipation: Definition, Pathophysiologie, Diagnostik und Therapie. (Memento des Originals vom 22. August 2017 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 588 kB), abgerufen am 20. August 2013.
- Dieter Schlee: Ökologische Biochemie. 2. Auflage. Gustav Fischer Verlag, Jena 1992, ISBN 3-334-60393-8, S. 309.
- Hans Beyer, Wolfgang Walter: Lehrbuch der organischen Chemie. 18. Auflage. S. Hirzel Verlag, Stuttgart 1978, ISBN 3-7776-0342-2, S. 560 ff.
- W. Arthur Green: Industrial Photoinitiators A Technical Guide. CRC Press, 2010, ISBN 978-1-4398-2746-8, S. 34 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Wasserstoffperoxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. November 2018.