Osteoklast
Osteoklasten (altgriechisch ὀστέον ostéon, deutsch ‚Knochen‘ und κλᾰστός klastós, deutsch ‚zerbrochen‘; Singular: der Osteoklast) sind mehrkernige Zellen, die durch Fusion von einkernigen Vorläuferzellen aus dem Knochenmark entstehen. Sie gehören zum mononukleär-phagozytären System (MPS). Ihre Hauptaufgabe ist die Resorption von Knochengewebe.
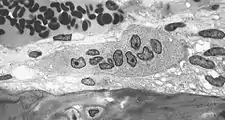
Osteoklasten entwickeln sich aus hämatopoetischen Stammzellen des Knochenmarkes. Sie zeigen teilweise Eigenschaften von zirkulierenden Monozyten und Gewebs-Makrophagen.
Regulation
Folgende Faktoren können die Formation von Osteoklasten anregen und wirken somit knochenresorptiv:
- Dexamethason
- 1,25-(OH)2VitD3
- Parathormon
- Parathormon-related Protein (PTHrP)
- Peroxisom-Proliferator-aktivierter Rezeptor-γ (PPARγ)
- Prostaglandin-E2
- Triiodthyronin (T3)
- verschiedene Zytokine
Folgende Faktoren können die Funktion von Osteoklasten hemmen und wirken somit antiresorptiv:
Diese Faktoren führen zu einer Aktivierung des PU.1-Transkriptionsfaktors, der die Umwandlung von Makrophagen in Osteoklasten verstärkt. Osteoklasten werden außerdem über den RANK-Liganden (RANKL) aktiviert. Osteoprotegerin (OPG) ist ein Protein, das die Osteoklastendifferenzierung hemmt, indem es die RANK-Liganden bindet. Diese Liganden können ihrerseits nun nicht mehr an das RANK der Makrophagen binden und sie daher auch nicht mehr zur Differenzierung zu Osteoklasten anregen. Auf diese Weise verhindert Osteoprotegerin den Abbau von Knochen.
Hormonell wird die Osteoklastenaktivität von Parathormon (Aktivierung, Calciumfreisetzung) und Calcitonin (Inaktivierung, Calciumspeicherung) gesteuert, der Knochen wird also als Zwischenspeicher von Calcium zur Regulation der Calciumhomöostase genutzt. Dabei ist jedoch anzumerken, dass der Osteoklast selbst keine Rezeptoren für das Parathormon besitzt, sondern die Aktivierung sekundär über die Osteoblasten (RANKL) erfolgt, welche diesen Rezeptor besitzen. Für Calcitonin besitzt der Osteoklast jedoch Rezeptoren, wodurch eine direkte Hemmung der Aktivität möglich ist.
Die Resorption von Knochen ist meist eng mit einer nachfolgenden Neusynthese durch Osteoblasten verknüpft. Dieser als Knochengeweberemodellierung bekannte Prozess dient der Anpassung an Belastungen und dem Vorbeugen von Materialermüdungen.
Histologie
Osteoklasten sind große Zellen mit einem Durchmesser von 50 bis 100 µm, die bis zu 10 Zellkerne enthalten können. Sie finden sich an der Knochenoberfläche in den Resorptionslakunen (Howship-Lakunen). Genauso wie die eng mit Ihnen verwandten Makrophagen sind sie in der Lage, sich amöboid fortzubewegen.
Der apikale Pol eines Osteoklasten ist dem Knochen zugewandt. Hier lassen sich verschiedene Bereiche unterscheiden:
- Zentral findet sich eine helle, streifige und vesikelreiche Zone, in der die Zellmembran in Form eines Bürstensaums stark gefaltet ist. Sie wird als ruffled border bezeichnet und ist der eigentliche Ort der Knochenresorption. Lichtmikroskopisch stellt sie sich hell-gestreift dar.
- In der Peripherie zeigt sich lichtmikroskopisch eine intensive Anfärbung. Dort haftet der Osteoklast mit seinem Adhäsionsapparat (Integrine) an der Knochensubstanz. Der Adhäsionsapparat besteht zumeist aus so genannten Podosomen. Es besteht ein sehr enger Kontakt zwischen Osteoklast und Knochen, mit einem Abstand von nur 0,3–0,5 nm. Man nennt diesen Bereich deshalb auch sealing zone.
- Das Zytoplasma, das die sealing zone umgibt, wird als clear zone bezeichnet, da es fast keine Zellorganellen aufweist. Dafür findet sich hier eine große Menge kontraktiler Proteine.
Physiologie
Im Zwischenraum von Osteoklast und Knochensubstanz herrscht ein deutlich erniedrigter pH-Wert (ca. 4,5), der durch aktiven Protonentransport aufrechterhalten wird und dem Abbau der mineralisierten Matrixkomponenten dient. Daneben geben Osteoklasten proteolytische Enzyme ab, die die kollagene Knochenmatrix auflösen. Die dabei freigesetzten Kollagenfragmente werden phagozytiert. Dabei entstehen die Howship-Lakunen, die man auch als „Fressspur“ der Osteoklasten bezeichnen kann. Ihre Kapazität ist beachtlich: Ein Osteoklast kann die gleiche Menge Knochen abbauen, die 100 Osteoblasten in dieser Zeit aufbauen.
Krankheiten
Verminderte Osteoklastentätigkeit
- Bei der genetisch bedingten Krankheitsgruppe der Osteopetrose und ihrer Unterform der Pyknodysostose ist die Osteoklastentätigkeit stark vermindert.
- PLOSL (polyzystische lipomembranöse Osteodysplasie mit sklerotischer Leukenzephalopathie, Nasu-Hakola-Krankheit)
Vermehrte Osteoklastentätigkeit
Eine vermehrte Osteoklastentätigkeit findet sich bei folgenden Krankheiten
- Osteoporose
- Hyperparathyreoidismus
- Osteodystrophia deformans (Morbus Paget)
- Aseptische Knochennekrose
- Rheumatoide Arthritis
- Osteogenesis imperfecta
- Brustkrebs
- Riesenzelltumor
- Gorham-Stout-Syndrom
Literatur
- T. Bellido u. a.: Regulation of interleukin-6, osteoclastogenesis, and bone mass by androgens. The role of the androgen receptor. In: J Clin. Invest. 95, 1995, S. 2886–2895.
- G. Girasole, R. L. Jilka, G. Passeri, S. Boswell, G. Boder, D. C. Williams, S. C. Manolanas: 17-Estradiol inhibits interleukin-6 production by bone marrow derived stromal cells and osteoblasts in vitro: A potential mechanism for the anti-osteoporotic effect of estrogens. In: J. Clin. Invest. 89, 1992, S. 883–891.
- G. Hattersley, J. A. Kirby, T. J. Chambers: Identification of osteoclast precursors in multilineage hematopoietic colonies. In: Endocrinology. 128, 1991, S. 259–262.
- R. L. Jilka u. a.: Increased osteoclast development after estrogen loss: Mediation by interleukin-6. In: Science. 257, 1992, S. 88–91.
- N. Kurihara, C. Chenu, M. Miller, C. Civin, G. D. Roodman: Identification of committed mononuclear precursors for osteoclast-like cells in long term human marrow cultures. In: Endocrinology. 126, 1990, S. 2733–2741.
- K. Matsuzaki u. a.: Osteoclast differentiation factor (ODF) induces osteoclast-like cell formation in human peripheral blood mononuclear cell cultures. In: Biochem Biophys Res Commun. 246, 1998, S. 199–204.
- N. K. Shevde, A. C. Bendixen, K. M. Dienger, J. W. Pike: Estrogens suppress RANK ligand-induced osteoclast differentiation via a stromal cell independent mechanism involving c-Jun repression. In: Proc Natl Acad Sci USA. 97, 2000, S. 7829–7834.
- M. M. Tondravi, S. R. McKercher, K. Anderson, J. M. Erdmann, M. Quiroz, R. Maki, S. L. Teitelbaum: Osteopetrosis in mice lacking haematopoietic transcription factor PU.1. In: Nature. 386, 1997, S. 81–84.
- K. Tsukii u. a.: Osteoclast differentiation factor mediates an essential signal for bone resorption induced by 1 alpha,25-dihydroxyvitamin D3, prostaglandin E2, or parathyroid hormone in the microenvironment of bone. In: Biochem Biophys Res Commun. 246, 1998, S. 337–341.