Landgang (Biologie)
Als Landgang bezeichnet man die allmähliche Anpassung von aquatischen Lebewesen an eine terrestrische Lebensweise, also den Prozess der Landbesiedelung durch zuvor ausschließlich an ein Leben im Wasser angepasste Organismen. Dies geschah wiederholt und unabhängig voneinander in verschiedenen Organismengruppen, so zum Beispiel bei Einzellern, Pilzen, Pflanzen, Ringelwürmern, Gliederfüßern, Schnecken und Wirbeltieren.

Mikroorganismen
Die ältesten Lebensspuren an Land stammen vermutlich von Mikroorganismen, die vor 3,48 Milliarden Jahren in heißen Quellen der heute so genannten Dresser-Formation in Westaustralien lebten.[1]
3,2 Milliarden Jahre alt sind die nächstjüngeren Lebensspuren von mutmaßlichen Mikroorganismen aus dem Paläoboden einer ehemaligen Flussebene im heutigen Südafrika. Es handelt sich um winzige Körnchen des Minerals Pyrit, bei denen insbesondere das Verhältnis der Schwefelisotope 34S und 32S als Anzeichen der Beeinflussung durch Mikroorganismen interpretiert wurde.[2]
Pflanzen
Durch fossile Belege relativ gut dokumentiert ist der Landgang der Pflanzen, der von den meisten Forschern heute auf die Zeit vor 480 bis 460 Millionen Jahren – ins frühe Ordovizium – datiert und teils auf frühe Arten der Schmuckalgen aus der Gruppe der Streptophyta zurückgeführt wird,[3] teils auf die Armleuchteralgen (Charophyceae oder Charales).[4] Möglicherweise erfolgte ihr Landgang in mutualistischer Symbiose mit Mykorrhizapilzen.[5]
Das Aufkommen von Landpflanzen entzog der Atmosphäre Kohlendioxid, ein Prozess, der durch von Pflanzen verursachte Verwitterungsprozesse des Bodens noch verstärkt wurde. Eine im Ordovizium nachweisbare, merkliche Abkühlung des Klimas wurde 2012 von einer Forschergruppe als Folge einer Beeinflussung des Kohlenstoffzyklus infolge der Landbesiedelung durch frühe Pflanzen interpretiert.[6] Als eine der frühesten, allerdings bereits gut an das Landleben angepassten Landpflanzen gilt Rhynia gwynne-vaughanii, die vor rund 400 Millionen Jahren im Devon lebte.
Gregory J. Retallack von der University of Oregon, ein Experte für Paläoböden,[7] argumentierte 2013, zumindest einige Arten der rund 600 Millionen Jahre alten Ediacara-Fauna seien Vertreter einer frühen Land-Flora gewesen, mit einer Wuchsform, die vergleichbar gewesen sei mit jener der heute lebenden Flechten oder mit Kolonien von Mikroorganismen.[8]
Einem Autorenteam der Pennsylvania State University zufolge könnten Grünalgen sowie mit Schlauchpilzen vergesellschaftete Cyanobakterien (d. h. früheste Vorformen der Flechten) noch deutlich früher das Land besiedelt haben: Mit Hilfe der „molekularen Uhr“ errechneten sie, dass Landpflanzen schon vor 700 Millionen Jahren (Cryogenium) erstmals festländische Areale besiedelt haben könnten, Grünalgen und Pilze sogar bereits vor einer Milliarde Jahren (Stenium/Tonium).[9] Für diese anhand von Protein-Sequenzen ermittelten Daten gibt es allerdings bislang kaum fossile Belege. Publiziert wurden 2011 jedoch zumindest Hinweise auf eukaryote Organismen, die seinerzeit „in Süßwasser oder an der Erdoberfläche“ lebten.[10]
2018 veröffentlichte eine Forschergruppe um Mark Puttick von der University of Bristol eine Studie, die die Existenz moosartiger Gewächse an Land vor etwa 515 Millionen Jahren (im mittleren Kambrium) nahelegt. Die Studie stützt sich vor allem auf Analysen der molekularen Uhr, aber auch auf Fossilien und Hinweise zu Verwandtschaftsbeziehungen zwischen den Pflanzengruppen.[11]
Die ältesten Hinweise auf Pflanzenwurzeln sind 407 Millionen Jahre alt und stammen von Asteroxylon mackiei, einer Art an der Basis der Bärlapppflanzen aus dem Rhynie Chert in Schottland.[12]
Gliederfüßer
Verschiedene Unterstämme der Gliederfüßer haben wohl mehrmals evolutionär parallel den „Schritt“ vom Wasser zum Land vollzogen, sowohl von marinen wie von süßwasserbewohnenden Formen aus (siehe auch analoge Entwicklungen). Dabei mag der feuchte Ufergrund für grabend-wühlende Formen ein geeignetes Übergangsfeld dargestellt haben.[13] Für die Insekten wurde anhand von DNA-Analysen („Molekulare Uhr“) berechnet, dass deren Vorfahren vor rund 480 Millionen Jahren von aquatischer zu landbesiedelnder Lebensweise übergingen und sich vor etwas mehr als 400 Millionen Jahren auch die Luft als Lebensraum erschlossen.[14] Für das 2,5 Zentimeter lange Fossil Kampecaris obanensis aus dem Silur in Schottland, das einem Tausendfüßer ähnelt, wurde ein Alter von 425 Millionen Jahre bestimmt.[15]
Wirbeltiere
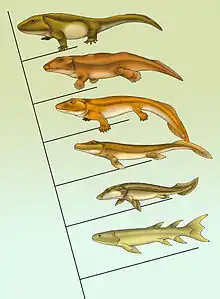
Eusthenopteron, Panderichthys, Tiktaalik, Acanthostega, Ichthyostega, Pederpes
Einer Studie aus dem Jahr 2016 zufolge existieren derzeit 130 Fisch-Arten aus 33 Familien, deren Individuen sich zeitweise an Land aufhalten. Daraus wurde geschlossen, dass auch der Landgang in der Ära der sogenannten Stammtetrapoden mehrfach erfolgt sein könnte.[17] Im Januar 2021 wurde zudem die DNA-Sequenzierung des vollständigen Erbgut vom Australischen Lungenfisch (Neoceratodus forsteri) veröffentlicht.[18] Demnach besitzen dieser Lungenfisch und der Mensch einige weitgehend „baugleiche“ Gene, die zum Beispiel die Embryonalentwicklung der Lunge steuern; die Lungen des Menschen und der anderen Landwirbeltiere können daher der Studie zufolge entwicklungsgeschichtlich auf eine gemeinsame Herkunft von den Lungenfischen zurückgeführt werden. Andere Gene scheinen für die Ausbildung zusätzlicher Knochen in den Flossen verantwortlich zu sein.[19]
Durch Fossilien gut abgesichert ist der Landgang der Wirbeltiere während des späten Devon,[20][21][22] also der evolutionäre Übergang von süßwasserlebenden Knochenfischen zu den frühesten Landwirbeltieren (Tetrapoden). Hier kann der Formenwandel im Zuge der Phylogenese dieser sogenannten Stammtetrapoden (auch „Fischapoden“ genannt), ausgehend von Vertretern wie Gogonasus über Arten, die Eusthenopteron, Panderichthys, Elginerpeton, Metaxygnathus, Tiktaalik und Ventastega ähnelten, zu den frühesten „echten“ vierbeinigen Formen, wie Acanthostega, Ichthyostega und Pederpes, anhand gut erhaltener Fundstücke relativ lückenlos nachvollzogen werden.[23] Unklar ist aber bisher, in welchem Abschnitt des Devons dieser Landgang erfolgte. Die ältesten Fossilien sind nämlich rund 18 Millionen Jahre jünger (Frasnium) als die ältesten, einem tetrapoden Lebewesen zugeschriebenen fossilen Trittsiegel, die auf ein Alter von 397 Millionen Jahre (Emsium) datiert wurden.[16] Im Zusammenhang mit letztgenannter Entdeckung wurde für die Epoche des Landgangs der Wirbeltiere der Zeitraum von vor 416 bis vor 359 Millionen Jahren veranschlagt.[24]
Welche Veränderungen im Erbgut zum Beispiel den „Umbau“ von Flossen in Füße ermöglichten, ist weitgehend ungeklärt. Jedoch scheinen Gene aus der Gruppe der 5'Hoxd-Gruppe – insbesondere Hoxd13 – daran beteiligt gewesen zu sein.[25] Während das postcraniale Skelett u. a. mit dem Verlust der unpaaren Flossen, dem Wandel der paarigen Flossen zu Beinen und der Loslösung des Schädels vom Schultergürtel, einhergehend mit der Reduktion des Kiemendeckels, umfangreiche Modifikationen erfuhr, blieb der Unterkiefer der frühen Tetrapoden noch über viele Millionen Jahre hinweg „fischartig“, und Form und Funktion variierten kaum zwischen den verschiedenen Arten. Erst vor etwa 320 Millionen Jahren, mit erscheinen der ersten Amnioten („Reptilien“) und amniotenartiger Tetrapoden, nahm die Variabilität in Form und Funktion der Unterkiefer zu. Dies wird mit dem Erwerb der Herbivorie in diesen „höheren“ Tetrapodengruppen in Zusammenhang gebracht.[26] Als Ursache für diese verzögerte Entwicklung wird vermutet, dass erst bei den amniotenartigen Tetrapoden und den frühen Amnioten der Rippenkorb und die daran ansitzende Atemmuskulatur eine funktionelle Einheit bildeten, mit deren Hilfe die Lunge, ähnlich einem Blasebalg geweitet und zusammengedrückt werden konnte (costale Ventilation), während die ursprünglicheren Tetrapoden die Luft mit Hilfe der Muskeln im Mundboden in die Lunge pressten (buccales Pumpen), wie es noch heute die Vertreter der modernen Amphibien tun. Der Übergang zur costalen Ventilation hatte zur Folge, dass der Unterkiefer in seiner speziellen Funktion als Ansatz für die Atemmuskulatur im Mundboden entlastet wurde, was wiederum die Entwicklung einer größeren Formenvielfalt erlaubte und damit auch Möglichkeiten für eine stärkere Nahrungsspezialisierung eröffnete.[26][27]
Die modernen Amphibien vollziehen im Laufe ihrer Individualentwicklung während der Metamorphose der Larve zum Frosch- oder Schwanzlurch innerhalb weniger Tage bis Wochen den Landgang der Tetrapoden nach, ein Beispiel für die Biogenetische Grundregel von Ernst Haeckel.
Der Landgang der Wirbeltiere könnte durch Umweltveränderungen im Zusammenspiel mit phänotypischer Plastizität seinen Anfang genommen haben. Gemeint ist die Variabilität des Phänotyps in Abhängigkeit von Umwelteinflüssen: Zwei Individuen der gleichen Art, die unter verschiedenen Umweltbedingungen heranwachsen, können geringfügig voneinander abweichende körperliche Merkmale entwickeln. Kanadische Evolutionsforscher unternahmen dazu ein Experiment mit heute lebenden Flösselhechten, um die damaligen Prozesse nachzubilden. Flösselhechte leben in den Süßgewässern des tropischen Afrika und gelten als die „primitivsten“ rezenten Strahlenflosser. Damit können sie als modernes Analogon zu den fischartigen Fleischflossern dienen, aus denen im Devon die ersten Landwirbeltiere hervorgingen. In einem achtmonatigen Versuch beobachteten sie, wie sich juvenile Senegal-Flösselhechte (Polypterus senegalus) körperlich entwickeln, wenn man ihnen die Möglichkeit, ins Wasser zu gehen, vollständig verwehrt. Infolge des fehlenden Auftriebs veränderte sich sowohl die Muskulatur als auch der Knochenbau, insbesondere der Brustflossen und des Schultergürtels. Dies geschah in einer ähnlichen Art und Weise wie es im Fossilbericht devonischer fischartiger Fleischflosser (z. B. Eusthenopteron), „Fischapoden“ (z. B. Tiktaalik) und frühester vierbeiniger Vertreter (z. B. Ichthyostega) zu beobachten ist. Die Versuchsindividuen konnten zudem signifikant besser auf dem Trockenen „laufen“ als die Individuen der überwiegend im Wasser gehaltenen Kontrollgruppe. Solche anfangs nur phänotypischen Adaptationen könnten vor 400 Millionen Jahren auch bei den fischartigen Vorläufern der Tetrapoden aufgetreten und erst nachfolgend durch genetische Mutationen via Selektion in der betroffenen Population fixiert worden sein.[28] Die evolutionäre Abfolge wäre demnach nicht: zufällige genetische Mutation → natürliche Selektion → Adaptation in der Population, sondern umgekehrt: Veränderung der Umweltbedingungen → dauerhafte, noch nicht genetisch vererbbare phänotypische Adaptation → genetische Fixierung (genetische Assimilation) der phänotypischen Adaptation durch zufällige Mutationen. Allerdings widerspricht dieses Szenario den bisherigen Erkenntnissen über die Evolution der Stammtetrapoden, wonach Beine und Zehen bereits vor dem Übergang zu einer terrestrischen Lebensweise entstanden sein sollen.[29]
Ein weiteres Beispiel für einen Strahlenflosser, der ansatzweise trockenes Terrain erobert hat, ist der Schlammspringer. Im Gegensatz zu den devonischen Stammtetrapoden und dem Flösselhecht handelt es sich beim Schlammspringer um einen „Landgang“ im randmarinen Milieu.
Eine Rekonstruktion des Tidenhubs vor rund 400 Millionen Jahren ergab das überall dort, wo die ersten Landwirbeltiere auftraten, auch Ebbe und Flut stark waren. Der Wechsel von Ebbe und Flut könnten für die Stammtetrapoden der Grund gewesen sein Anpassungen zu entwickeln, die ihnen schließlich den Wechsel zu einem Leben an Land ermöglicht haben.[30]
Literatur
- Jennifer L. Morris u. a.: The timescale of early land plant evolution. In: PNAS. Band 115, Nr. 10, 2018, E2274–E2283, doi:10.1073/pnas.1719588115, Volltext (PDF)
- Gregory J. Retallack: Woodland Hypothesis for Devonian Tetrapod Evolution. In: The Journal of Geology. Band 119, Nr. 3, 2011, S. 235–258, doi:10.1086/659144, Volltext (PDF)
- Blake V. Dickson, Jennifer A. Clack u. a.: Functional adaptive landscapes predict terrestrial capacity at the origin of limbs. In: Nature. Band 589, 2020, S. 242–245, doi:10.1038/s41586-020-2974-5.
Weblinks
- Grünalgen bereiteten Landgang der Pflanzen vor. Auf: idw-online.de vom 19. April 2018.
- Video: Alticus arnoldorum, ein Meeresfisch von Guam, auf Felsen außerhalb des Wassers.
- Strong tides may have pushed ancient fish to evolve limbs. Auf: sciencemag.org vom 15. Februar 2018.
- How the first life on Earth survived its biggest threat — water. Auf: nature.com vom 9. Dezember 2020.
Belege
- Tara Djokic u. a.: Earliest signs of life on land preserved in ca. 3.5 Ga hot spring deposits. In: Nature Communications. Band 8, 2017, Artikel-Nr. 15263,
doi:10.1038/ncomms15263
Oldest evidence of life on land found in 3.48-billion-year-old Australian rocks. Auf: eurekalert.org vom 9. Mai 2017. - Sami Nabhan, Michael Wiedenbeck, Ralf Milke und Christoph Heubeck: Biogenic overgrowth on detrital pyrite in ca. 3.2 Ga Archean paleosols. In: Geology. Band 44, Nr. 9, 2016, S. 763 ff., doi:10.1130/G38090.1
Das Leben an Land ist 300 Millionen Jahre älter als gedacht. Auf: idw-online.de. 7. November 2016. - Jan de Vries, Bruce A. Curtis, Sven B. Gould, John M. Archibald: Embryophyte stress signaling evolved in the algal progenitors of land plants. In: PNAS. Band 115, Nr. 15, E3471–E3480, 2018, doi:10.1073/pnas.1719230115.
- Tomoaki Nishiyama, Hidetoshi Sakayama u. a.: The Chara Genome: Secondary Complexity and Implications for Plant Terrestrialization. In: Cell. Band 174, Nr. 2, 2018, S. 448–464.e24, doi:10.1016/j.cell.2018.06.033.
Feste Zellwand bereitete Landgang vor. Auf: idw-online.de vom 12. Juli 2018. - Mélanie K. Rich et al.: Lipid exchanges drove the evolution of mutualism during plant terrestrialization. In: Science. Band 372, Nr. 6544, 2021, S. 864–868, doi:10.1126/science.abg0929.
Pflanzen-Pilz-Symbiose: Urzeitlicher Landgang mit Freunden. Auf: wissenschaft.de vom 20. Mai 2021. - Timothy M. Lenton, Michael Crouch Martin Johnson, Nuno Pires, Liam Dolan: First plants cooled the Ordovician. In: Nature Geoscience. Band 5, 2012, S. 86–89, doi:10.1038/ngeo1390.
- L. Paul Knauth: Not all at sea. In: Shuhai Xiao, L. Paul Knauth: Forum Palaeontology: Fossils come in to land. In: Nature. Band 493, Nr. 7430, 2013, S. 28–29, doi:10.1038/nature11765.
- Gregory J. Retallack: Ediacaran life on land. In: Nature. Band 493, Nr. 7430, 2013, S. 89–92, doi:10.1038/nature11777.
- Daniel S. Heckman, David M. Geiser, Brooke R. Eidell, Rebecca L. Stauffer, Natalie L. Kardos, S. Blair Hedges: Molecular Evidence of the Early Colonization of Land by Fungi and Plants. In: Science. Band 293, Nr. 5532, 2001, S. 1129–1133, doi:10.1126/science.1061457.
- Paul K. Strother, Leila Battison, Martin D. Brasier, Charles H. Wellman: Earth’s earliest non-marine eukaryotes. In: Nature. Band 473, Nr. 7348, 2011, S. 505–509, doi:10.1038/nature09943.
- Jennifer L. Morris u. a.: The timescale of early land plant evolution. In: PNAS. Band 115, Nr. 10, 2018, E2274–E2283, doi:10.1073/pnas.1719588115.
Martin Vieweg: Landgang der Pflanzen vordatiert. In: wissenschaft.de datum = 2018-02-19. Abgerufen am 25. März 2018. - Alexander J. Hetherington et al.: An evidence-based 3D reconstruction of Asteroxylon mackiei, the most complex plant preserved from the Rhynie chert. In: eLife. 2021, 10, e69447, doi:10.7554/eLife.69447.
Wie sich die ersten Wurzeln vor mehr als 400 Millionen Jahren entwickelten. Auf: idw-online.de vom 24. August 2021. - M. G. Villani u. a.: Adaptive strategies of edaphic arthropods. In: Annual Review of Entomology. Band 44, 1999, S. 233–256 doi:10.1146/annurev.ento.44.1.233.
- Bernhard Misof u. a.: Phylogenomics resolves the timing and pattern of insect evolution. In: Science. Band 346, Nr. 6210, 2014, S. 763–767, doi:10.1126/science.1257570
Spektakulärer Erfolg: Forscher klären die Evolution der Insekten mittels DNA-Analysen auf. Auf: idw-online vom 6. November 2014. - M. E. Brookfield, E. J. Catlos, S. E. Suarez: Myriapod divergence times differ between molecular clock and fossil evidence: U/Pb zircon ages of the earliest fossil millipede-bearing sediments and their significance. In: Historical Biology. Online-Veröffentlichung vom 15. Mai 2020, doi:10.1080/08912963.2020.1762593.
Scientists find oldest fossil of a land animal. Auf: cbc.ca vom 1. Juni 2020. - Grzegorz Niedźwiedzki u. a.: Tetrapod trackways from the early Middle Devonian period of Poland. In: Nature. Band 463, 2010, S. 43–48, doi:10.1038/nature08623.
- Terry J. Ord, Georgina M. Cooke: Repeated evolution of amphibious behavior in fish and its implications for the colonisation of novel environments. In: Evolution. Band 70, Nr. 8, 2016, S. 1747–1759, doi:10.1111/evo.12971
Fish may have evolved to live on land more than 30 times. Auf: sciencemag.org vom 16. Juni 2016. - Axel Meyer u. a.: Giant lungfish genome elucidates the conquest of land by vertebrates. In: Nature. Online-Veröffentlichung vom 18. Januar 2021, doi:10.1038/s41586-021-03198-8.
Was das Genom des Lungenfischs über die Landeroberung der Wirbeltiere verrät. Auf: idw-online.de vom 18. Januar 2021. - M. Brent Hawkins, Katrin Henke, Matthew P. Harris: Latent developmental potential to form limb-like skeletal structures in zebrafish. In: Call. Online-Veröffentlichung vom 4. Februar 2021, doi:10.1016/j.cell.2021.01.003.
Mutant zebrafish with extra fin bones may hold clues to how the first animals walked on land. Auf: sciencemag.org vom 4. Februar 2021. - Jennifer Clack: Gaining Ground, Second Edition: The Origin and Evolution of Tetrapods. Second Edition. Indiana University Press, Bloomington (IN) 2012, ISBN 978-0-253-35675-8.
- Robert Carroll: The Rise of Amphibians: 365 Million Years of Evolution. Johns Hopkins University Press, Baltimore (MD) 2009, ISBN 978-0-8018-9140-3.
- Michael J. Benton: Paläontologie der Wirbeltiere. Übersetzung der 3. englischen Auflage durch Hans-Ulrich Pfretzschner. Verlag Dr. Friedrich Pfeil, München 2007, ISBN 978-3-89937-072-0, S. 88 ff.
- Donald Prothero: What missing link? Reports of huge gaps in the fossil record have been greatly exaggerated. In: New Scientist. Nr. 2645, S. 35–41, doi:10.1016/S0262-4079(08)60548-5 (alternativer Volltextzugriff: donaldprothero.com).
- Philippe Janvier, Gaël Clément: Palaeontology: Muddy tetrapod origins. In: Nature. Band 463, Nr. 7277, 2010, S. 40–41, doi:10.1038/463040a.
- Renata Freitas Carlos Gómez-Marín, Jonathan Mark Wilson, Fernando Casares, José Luis Gómez-Skarmeta: Hoxd13 Contribution to the Evolution of Vertebrate Appendages. In: Developmental Cell. Band 23, Nr. 6, 2012, S. 1219–1229, doi:10.1016/j.devcel.2012.10.015; siehe hierzu auch From Fish to Human: Research Reveals How Fins Became Legs. Auf: sciencedaily.com vom 10. Dezember 2012.
- Philip S. L. Anderson, Matt Friedman, Marcello Ruta: Late to the Table: Diversification of Tetrapod Mandibular Biomechanics Lagged Behind the Evolution of Terrestriality. In: Integrative and Comparative Biology. Band 53, Nr. 2, 2013, S. 197–208, doi:10.1093/icb/ict006.
- Christine M. Janis, Julia C. Keller: Modes of ventilation in early tetrapods: Costal aspiration as a key feature of amniotes. In: Acta Palaeontologica Polonica. Band 46, Nr. 2, 2001, S. 137–170 (online).
- Emily M. Standen, Trina Y. Du, Hans C. E. Larsson: Developmental plasticity and the origin of tetrapods. In: Nature. Band 513, 2014, S. 54–58, doi:10.1038/nature13708.
How fish can learn to walk – Land-raised bichirs provide insight into evolutionary pressures facing first vertebrates to live on land. Video auf nature.com vom 27. August 2014 (englisch). - Stephanie E. Pierce, Jennifer A. Clack, John R. Hutchinson: Three-dimensional limb joint mobility in the early tetrapod Ichthyostega. In: Nature. Bd. 486, Nr. 7404, 2012, S. 523–526, doi:10.1038/nature11124.
- H. M. Byrne, J. A. M. Green, S. A. Balbus, P. E. Ahlberg: A key environmental driver of osteichthyan evolution and the fish-tetrapod transition? In: Proceedings of the Royal Society A. Band 476, Nr. 2242, Oktober 2020, doi:10.1098/rspa.2020.0355.
Halfen die Gezeiten den Urzeit-Fischen ans Land? Starker Tidenhub könnte den Landgang der Wirbeltiere begünstigt haben. Auf: scinexx.de vom 2. November 2020.