Perkin-Reaktion
Die Perkin-Reaktion ist eine Namensreaktion und nach dem englischen Chemiker Sir William Henry Perkin (1838–1907) benannt.[1][2] Die erste von ihm derartig synthetisierte Verbindung war Zimtsäure. Allgemein ist die Perkin-Reaktion[3] eine Kondensation aromatischer Aldehyde mit Acetanhydrid in Anwesenheit von Natriumacetat[4] zur Bildung α,β-ungesättigter Carbonsäuren. Aromatische Derivate dieser Verbindungen werden auch als Zimtsäuren bezeichnet. Die Perkin-Reaktion läuft nach dem Prinzip der Aldolkondensation ab und ist zudem eng verwandt mit der Knoevenagel-Reaktion.
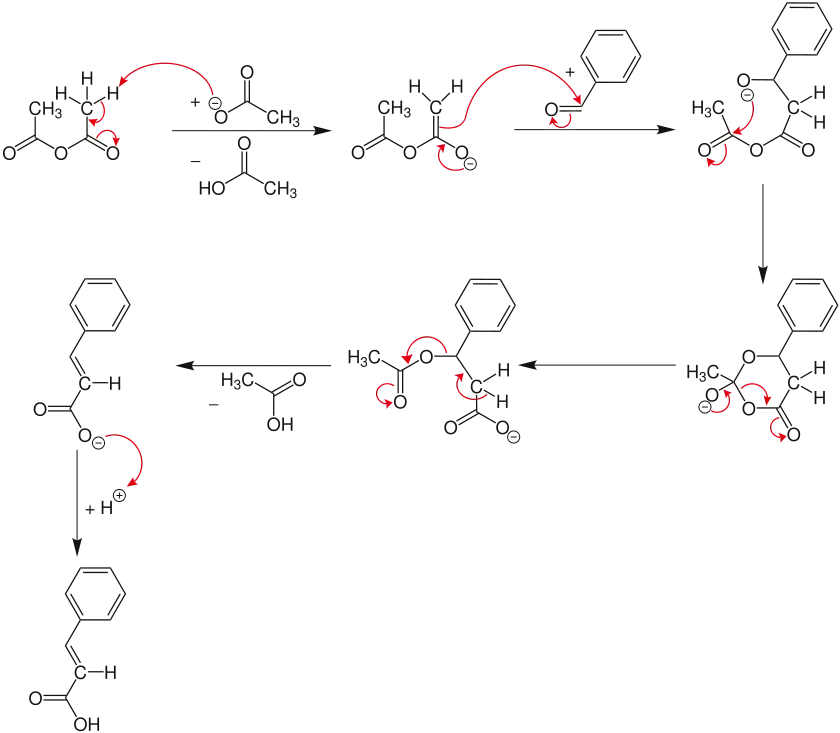
Mechanismus
Der Mechanismus der Perkin-Reaktion verläuft im Basischen, zunächst bildet sich das Anion des Säureanhydrids. Grund hierfür ist die C-H-Acidität des Säureanhydrids in α-Stellung. Im nächsten Schritt addiert das Anion nukleophil an den Carbonylkohlenstoff des Aldehyds.
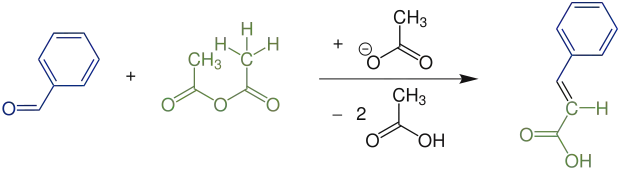
Der einfachste Fall, der auch von Perkin durchgeführt wurde, ist die Reaktion mit Methylgruppen in α-Stellung (R=H) und einer Phenylgruppe als Aryl-Rest. Aus Benzaldehyd und Essigsäureanhydrid wurde dabei Zimtsäure (und Essigsäure) synthetisiert. Wenn nur ein α-Wasserstoffatom vorhanden ist, bleibt die Reaktion bei der β-Hydroxycarbonsäure stehen. Es entsteht bevorzugt (aber nicht nur) das (E)-Diastereomer. Eine weitere Variante der Perkin-Reaktion ist die Erlenmeyer-Plöchl-Synthese zur Synthese von Aminosäuren und α-Ketosäuren.
Praxis
Es handelt sich bei dieser Reaktion um eine sog. Eintopfreaktion, d. h. Aldehyd, Säureanhydrid und Base werden gemischt und mehrere Stunden auf 170–200 °C erhitzt. Als Base verwendet man meist das Natriumsalz der dem Anhydrid entsprechenden Carbonsäure. Allerdings hat sich herausgestellt, dass Cäsiumsalze die Reaktionsausbeute mitunter drastisch verbessern und die nötige Reaktionszeit verkürzen. Wurden Kronenether eingesetzt, die das Kation komplexieren, blieb die Reaktion ganz aus. Das legte den Befund nahe, dass nicht die erhöhte Basizität aufgrund von schwächeren Kontaktionenpaaren bei den schwereren Alkali-Kationen ausschlaggebend für eine bessere Enolisierung und damit Beschleunigung der Reaktion sind, als vielmehr, dass diese Ionen die Edukte besser vorkomplexieren bzw. katalysieren.
Literatur
- House, H. O. Modern Synthetic Reactions (W. A. Benjamin, Menlo Park, California, 2. Auflage, 1972) S. 660–663.
- Rosen, T.; Comp. Org. Syn. 1991, 2, 395–408.
- E. Koepp, F. Vögtle: Perkin-Synthese mit Cäsiumacetat. In: Synthesis. Nr. 2, 1987, S. 177–179, doi:10.1055/s-1987-27880.
Siehe auch
Einzelnachweise
- W. H. Perkin: XXIII.—On the hydride of aceto-salicyl. In: Journal of the Chemical Society. Band 21, 1868, S. 181–186, doi:10.1039/JS8682100181.
- W. H. Perkin: XI.—On the formation of coumarin and of cinnamic and of other analogous acids from the aromatic aldehydes. In: Journal of the Chemical Society. Band 31, 1877, S. 388–427, doi:10.1039/JS8773100388.
- J. R. Johnson: o.A. In: Org. React., 1942, 1, 210–266.
- R. Brückner: Reaktionsmechanismen: Organische Reaktionen, Stereochemie, Moderne Synthesemethoden. 3. Auflage. Spektrum, 2004, ISBN 3-8274-1579-9, S. 568.