Bindigkeit
Die Bindigkeit (auch Bindungswertigkeit, Kovalenz) benennt die Anzahl der Atombindungen, die ein Atom eines chemischen Elements innerhalb eines Moleküls eingeht. In der Lewis- oder Strukturformel drückt man sie durch die Anzahl der Valenzstriche, ausgehend von einem Atom, aus.[1]
So sind zum Beispiel die beiden Kohlenstoffatome (C) im Ethan (C2H6) vierbindig, da sie vier Bindungen besitzen. Die Wasserstoffatome (H) sind mit ihrer einen Bindung also einbindig. Im Ammoniak (NH3) ist das Stickstoffatom (N) dreibindig und die Wasserstoffatome wieder einbindig. Im Formaldehyd (CH2O) kommt eine Doppelbindung vor: hier ist der Kohlenstoff wieder vierbindig, beide Wasserstoffatome einbindig und der Sauerstoff (O) zweibindig.

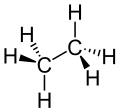 Ethan
Ethan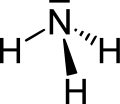 Ammoniak
Ammoniak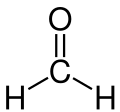 Formaldehyd
Formaldehyd
Die Bindigkeit wird hauptsächlich durch die Anzahl der einfach besetzten Atomorbitale (AO) bestimmt. Ein einfach besetztes Orbital ist ein Orbital, in dem sich nur ein Elektron befindet. So besitzt der Wasserstoff ein einfach besetztes s-Orbital (1s1), weshalb er einbindig ist. Beim Stickstoff sind die drei einfachbesetzten p-Orbitale der zweiten Schale (2p3 in der Konfiguration 1s2, 2s2, 2p3) dafür verantwortlich, dass er dreibindig ist.
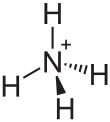
Allerdings muss hier berücksichtigt werden, dass es auch Elemente gibt, die durch Hybridisierung mehr Bindungen zur Verfügung stellen, so dass hier die Zahl der einfach besetzten Hybridorbitale zählt. Ein Beispiel dafür ist der Kohlenstoff, der im Grundzustand aufgrund seiner zwei einfach besetzten p-Orbitale (1s2, 2s2, 2p2) zweibindig wäre. Allerdings wird der Kohlenstoff vor der Bindung zu dem Valenzzustand (1s2, 2sp3) angeregt, in dem 4 einfachbesetzte sp3-Orbitale vorliegen, so dass er vier Bindungen eingehen kann, also vierbindig ist.
Eine weitere Ausnahme stellen Atome mit freien Elektronenpaaren dar. Hier können diese freien Elektronenpaare für eine Bindung eingesetzt werden (Koordinative Bindung), indem die beiden Elektronen des Elektronenpaars in die Bindung mit eingebracht werden. Ein Beispiel ist hier der Stickstoff der im Ammoniumion (NH4+) an vier Wasserstoffe bindet, da er mit seinem freien Elektronenpaar eine vierte Bindung eingegangen ist, somit also vierbindig ist.
Einzelnachweise
- Eintrag zu bond number. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.B00705 – Version: 2.3.