Nilblau
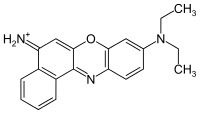
Nilblau, oft auch als Nilblau A (meist nur das Hydrogensulfat) bezeichnet, ist ein fluoreszierender Phenoxazin-Farbstoff.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Nilblau | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C20H20N3O+ | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 318,39 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser (50 g·l−1 bei 25 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Als Indikatorfarbstoff zeigt Nilblau im sauren Milieu eine blaue Farbe und ist im Alkalischen rot.
Durch Kochen einer Lösung von Nilblau mit Schwefelsäure entsteht der Farbstoff Nilrot.
Eigenschaften

V. l. n. r.: 1000 ppm, 100 ppm, 10 ppm, 1 ppm, 100 ppb.

V. l. n. r.: pH 0, pH 4, pH 7, pH 10, pH 14.

V. l. n. r.: pH 0, pH 4, pH 7, pH 10, pH 14

V. l. n. r.: pH 0, pH 4, pH 7, pH 10, pH 14

V. l. n. r.: 1. Methanol, 2. Ethanol, 3. tert-Butylmethylether, 4. Cyclohexan, 5. n-Hexan, 6. Aceton, 7. Tetrahydrofuran, 8. Ethylacetat, 9. Dimethylformamid, 10. Acetonitril, 11. Toluol, 12. Chloroform
Nilblau ist ein Fluoreszenzfarbstoff. Die Fluoreszenz zeigt besonders in apolaren Lösungsmitteln eine hohe Quantenausbeute:[4]
Die Absorption und Emissionsmaxima von Nilblau sind stark abhängig vom pH-Wert und dem verwendeten Lösungsmittel (Solvatochromie).
| Lösungsmittel | Absorption λmax (nm) |
Emission λmax (nm) | |
|---|---|---|---|
| Toluol | 493 | 574 | |
| Aceton | 499 | 596 | |
| Dimethylformamid | 504 | 598 | |
| Chloroform | 624 | 647 | |
| 1-Butanol | 627 | 664 | |
| 2-Propanol | 627 | 665 | |
| Ethanol | 628 | 667 | |
| Methanol | 626 | 668 | |
| Wasser | 635 | 674 | |
| 0,1 N Salzsäure | (pH = 1,0) | 457 | 556 |
| 0,1 N Natronlauge | (pH = 13,0) | 522 | 668 |
| Ammoniakwasser | (pH = 11,0) | 524 | 668 |
Die Fluoreszenzdauer von Nilblau wurde in Ethanol mit 1,42 ns bestimmt. Dies ist kürzer als der entsprechende Wert von Nilrot mit 3,65 ns. Die Fluoreszenzdauer ist relativ invariant gegenüber Verdünnungen im Bereich von 10−3 – 10−8 mol·dm−3.[4]
Die Nilblau-Färbung
Nilblau wird zur histologischen Anfärbung biologischer Präparate verwendet. Dabei gelingt die Unterscheidung zwischen neutralen Lipiden (Triglyceride, Cholesterinester, Steroide), die rosa angefärbt werden, und sauren (Fettsäuren, Chromolipide, Phospholipide), die blau angefärbt werden.[5]
Die Nilblau-Färbung nach Kleeberg benötigt folgende Chemikalien:
- Nilblau A
- 1%ige Essigsäure
- Glycerin bzw. Glyceringelatine
Der Arbeitsablauf
Das Präparat wird in Formol fixiert. Daraus werden Gefrierschnitte oder Zupfpräparate hergestellt. Anschließend werden sie für 20 Minuten in die Nilblau-Lösung getaucht und danach mit Wasser abgespült. Zur besseren Differenzierung wird in 1%ige Essigsäure für 10–20 Minuten eingetaucht, bis die Farbtöne rein sind. Dies kann u. U. schon nach 1–2 Minuten der Fall sein. Dann wird in mehrfach gewechseltem Wasser gründlich gewässert (ein bis zwei Stunden). Danach kann das angefärbte Präparat auf einen Objektträger gezogen und der Wasserüberschuss abgesaugt werden. Der Einschluss des Präparates kann in Glycerin oder lauwarmer Glyceringelatine erfolgen.
Das Ergebnis
Ungesättigte Glyceride sind rosa, Kerne und Elastica dunkelblau, Fettsäuren und zahlreiche Fettsubstanzen und Fettgemische blau bis violett gefärbt.[6]
Beispiel: Nachweis von Poly-β-hydroxybutyrat-Granula (PHB)
Die PHB-Granula in den Zellen von Pseudomonas solanacearum können durch Anfärbung mit Nilblau A sichtbar gemacht werden. Die PHB-Granula der gefärbten Ausstriche zeigen unter einem Epifluoreszenzmikroskop bei 450 nm Anregungswellenlänge unter Ölimmersion, bei 1000-facher Vergrößerung eine kräftige orangefarbene Fluoreszenz.[7]
Nilblau in der Onkologie
Derivate des Nilblau sind potentielle Photosensibilisatoren in der photodynamischen Therapie (PDT) von malignen Tumoren. Diese Farbstoffe werden durch Farbstoffaggregation in den Tumorzellen, speziell in den Lipidmembranen und/oder sequestriert in den subzellularen Organellen, stark angereichert.[8]
Mit dem Nilblau-Derivat N-Ethyl-Nilblau (EtNBA) konnte in Tierversuchen zwischen normalem und prämalignem Gewebe mittels Fluoreszenzbildgebung beziehungsweise Fluoreszenzspektroskopie unterschieden werden. EtNBA zeigt dabei keine phototoxischen Effekte.[9]
Herstellung
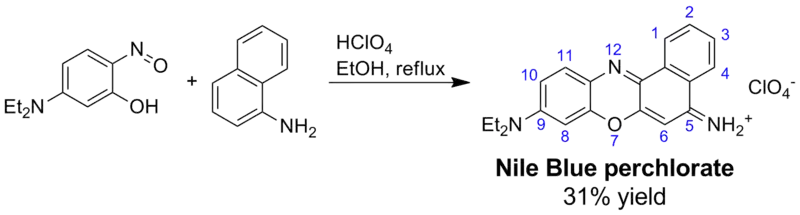
Nilblau und verwandte Napthoxaziniumfarbstoffe können auf verschiedenen Wegen hergestellt werden.
- Säurekatalysierte Kondensation von 5-(Dialkylamino)-2-nitrosophenolen mit 1-Naphthylamin
- 3-(Dialkylamino)phenolen mit N-alkylierten 4-Nitroso-1-naphthylaminen
- N,N-Dialkyl-1,4-phenylenediaminen mit 4-(Dialkylamino)-1,2-naphthoquinonen
Alternativ kann das Produkt einer säurekatalysierten Kondensation von 4-Nitroso-N,N-dialkylanilin mit 2-Naphthol in Gegenwart von Aminen oxidiert werden und so ein zweiter Aminsubstituent in 5-Position eingeführt werden.[10] Das folgende Formelschema zeigt die erste Synthesemöglichkeit
Einzelnachweise
- Eintrag zu Nilblau A. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juni 2014.
- Datenblatt Nilblau (PDF) bei Merck, abgerufen am 3. Juni 2008.
- Datenblatt Nile Blue A bei Sigma-Aldrich, abgerufen am 9. Mai 2017 (PDF).
- Jiney Jose and Kevin Burgess: Benzophenoxazine-based fluorescent dyes for labeling biomolecules, in Tetrahedron, 2006, 62, S. 11021–11037; doi:10.1016/j.tet.2006.08.056.
- Roche Lexikon, abgerufen am 25. Juni 2007.
- Benno Romeis, Mikroskopische Technik, 15. Aufl., R. Oldenbourg Verlag, München 1948.
- 97/647/EG: Entscheidung der EU-Kommission vom 9. September 1997 über ein vorläufiges Versuchsprogramm für Diagnose, Nachweis und Identifizierung von Pseudomonas solanacearum (Smith) Smith in Kartoffeln, abgerufen am 27. Juni 2007.
- C.W. Lin, J.R. Shulok, S.D. Kirley, L. Cincotta, J.W. Foley: Lysosomal localization and mechanism of uptake of Nile blue photosensitizers in tumor cells, in: Cancer Research, 1991, 51, S. 2710–2719; PMID 2021950.
- H.J. van Staveren: Fluorescence imaging and spectroscopy of ethyl nile blue A in animal models of (pre)malignancies, in: Photochemistry and photobiology, 2001, 73, S. 32–38; PMID 11202363.
- Andreas Kanitz, Horst Hartmann: Preparation and Characterization of Bridged Naphthoxazinium Salts. In: European Journal of Organic Chemistry. 1999, S. 923–930, doi:10.1002/(SICI)1099-0690(199904)1999:4<923::AID-EJOC923>3.0.CO;2-N.
Literatur
- F.J. Green: The Sigma-Aldrich Handbook of Stains, Dyes and Indicators, Aldrich Chemical Company, Milwaukee, 1990.
- J. Rao, A. Dragulescu-Andrasi, H. Yao: Fluorescence imaging in vivo: recent advances, in: Current Opinion in Biotechnology, 2007, 18, S. 17–25; PMID 17234399.