Fluoreszenztomographie
Die Fluoreszenztomographie ist ein in der In-vivo-Diagnostik verwendetes bildgebendes Verfahren. Sie ist eine spezielle Form der diffusen optischen Tomographie. Mit der Fluoreszenztomographie kann die Verteilung von Fluorophoren in biologischem Gewebe dreidimensional erfasst und quantifiziert werden. Die hohe Sensitivität des Verfahrens ermöglicht die Anwendung zur Molekularen Bildgebung. Das Verfahren wird vor allem in der Forschung und in präklinischen Studien verwendet.
In der Literatur sind auch andere Bezeichnungen für die Fluoreszenztomographie, wie beispielsweise Fluoreszenzbildgebung (engl. fluorescence imaging), üblich. In der englischsprachigen Fachliteratur gibt es bisher noch keinen einheitlich verwendeten Namen für dieses Verfahren. So werden unter anderem die Begriffe fluorescence molecular tomography[1][2] fluorescence tomography,[3][4][5] fluorescence(-enhanced) optical tomography,[6] oder fluorescence optical diffusion tomography[7] verwendet.[8]
Verfahren

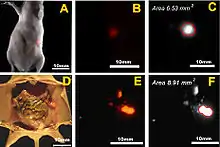
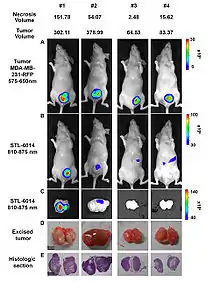
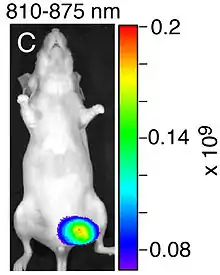
Zeile B: Fusionsbild Tageslicht-/NIR-Aufnahme (810–875 nm) der Maus, zeigt nur die nekrotischen Bereiche des Tumors
Zeile C: Fusionsbild Tageslicht-/NIR-Aufnahme des exzidierten Tumors
Zeile D: Tageslichtaufnahme des exzidierten Tumors
Zeile E: Histologischer Schnitt durch den angefärbten Tumor (HE-Färbung)[11]
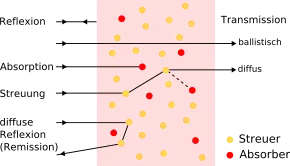
Die Fluoreszenztomographie wird üblicherweise im Nahinfrarotbereich (NIR) durchgeführt. Im Bereich von etwa 700 bis 900 nm Wellenlänge hat das Körpergewebe nur eine geringe Lichtabsorption. Wichtig ist hierbei vor allem die geringe Absorption von Hämoglobin und Wasser. Hämoglobin ist in „typischem“ Gewebe mit 29 Prozent Fett- und 8 Prozent Blutanteil für 39 bis 64 Prozent der Absorption des NIRs verantwortlich und somit der bestimmende Faktor.[12] In diesem „spektralen Fenster“ von 700 bis 900 nm kann die Strahlung von Fluoreszenzfarbstoffen, die im nahinfraroten Bereich des Spektrums emittieren, das Gewebe verhältnismäßig gut durchdringen. Die Restabsorption ist zusammen mit Streueffekten des Gewebes der begrenzende Faktor des Verfahrens, das derzeit die Anwendung auf kleine Gewebevolumina, oberflächliche Fluorophoranreicherungen und Kleintiere ohne Fell (beispielsweise Nacktmäuse) einschränkt.[13] Die Streueffekte werden durch unterschiedliche Brechungsindizes von extra- und intrazellulären Strukturen hervorgerufen.[14] Die Streuung der Photonen an den Zellmembranen und Zellorganellen ist eines der Hauptprobleme aller optischer bildgebender Verfahren. Durch die Entwicklung laufzeitselektiver Verfahren ist es mittlerweile möglich, die stark gestreuten Photonen von den weniger stark gestreuten Photonen für die Bildgebung abzutrennen.[15] Weitere Vorteile des NIR-Bereiches sind die geringe Autofluoreszenz des Körpergewebes und die – im Vergleich zum Röntgen, der Computertomographie (CT) und den nuklearmedizinischen Verfahren Positronen-Emissions-Tomographie (PET) und Einzelphotonen-Emissionscomputertomographie (SPECT) – gefahrlose Form der nichtionisierenden Strahlung.[16]
Die Auflösung der Fluoreszenztomographie kann in Kleintieren im Idealfall bis herab in den Submillimeterbereich reichen.[17] Die Eindringtiefe ist auf maximal etwa 50 mm begrenzt.[13][18]
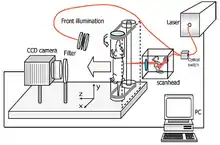
Dem Versuchstier wird vor der Untersuchung ein Fluoreszenzmarker – meist intravenös – verabreicht. Der Vorgang der Farbstoffverteilung und Anreicherung im Zielgewebe kann zeitaufgelöst beobachtet werden. Der Körper des Tiers wird mit einer NIR-Lichtquelle bestrahlt. Dies ist in der Regel ein NIR-Laser, beispielsweise mit einer Emissionswellenlänge von 780 nm, der die Oberfläche des Tieres abtastet (scan). Mit einer NIR-Kamera, beispielsweise einer CMOS-Kamera mit entsprechendem Filter, wird das bestrahlte Objekt aufgenommen. Dabei erfasst die Kamera nur die emittierte längerwellige (Stokes-Shift) Infrarotstrahlung und nicht das durch das Filter absorbierte Licht des Lasers (Anregungsquelle). Von dem Tier können Aufnahmen aus verschiedenen Richtungen gemacht werden. Dazu wird meist das Tier um die feststehende Kamera gedreht. In einem Datenverarbeitungssystem können die verschiedenen Aufnahmen zu einem 3D-Film zusammengesetzt werden. Darüber hinaus kann so das Volumen des mit dem NIR-Fluoreszenzfarbstoff markierten Gewebes – beispielsweise eines Tumors – quantitativ erfasst werden.
In vielen Fällen werden zur besseren Lokalisierung der Lage der Fluoreszenz auch noch Aufnahmen im sichtbaren Licht getätigt. Diese können dann zusammen mit den Fluoreszenzaufnahmen zu Fusionsbildern überlagert werden.
Fluoreszenzbiomarker
Für die Fluoreszenztomographie werden meist Fluoreszenzbiomarker, bestehend aus einem Liganden und einem Fluorophor eingesetzt. In besonderen Fällen können auch nicht konjugierte Fluorophore als „Kontrastmittel“, beispielsweise in der Angiografie bei Verbrennungen, verwendet werden.[19] Mit Indocyaningrün (ICG) ist seit 1959 ein NIR-Fluoreszenzfarbstoff für die Anwendung als Diagnostikum im Menschen zugelassen. Jede Konjugation mit einem Liganden führt zu einer neuen nicht zugelassenen Substanz, einer new chemical entity (NCE). Es ist gegenwärtig kein konjugierter Fluoreszenzbiomarker für die Anwendung im Menschen zugelassen.
Liganden
Als Liganden kommen prinzipiell die Verbindungen in Frage, die auch in der Nuklearmedizin verwendet werden. So können Peptide,[20][21][22] Proteine (beispielsweise monoklonale Antikörper oder deren Fragmente)[23] oder Aptamere[24][25][26] zur Konjugation mit einem Fluorophor für die Fluoreszenztomographie verwendet werden.
Fluorophore
Als Fluorophore werden in Modellorganismen im Wesentlichen NIR-Fluoreszenzfarbstoffe, vor allem aus der Gruppe Polymethine, wie beispielsweise Cyanine, eingesetzt. Diese organischen Farbstoffe haben in ihrer Anwendung allerdings einige intrinsische Nachteile. Die Quantenausbeute liegt im Wässrigen meist unter 15 Prozent. Pro Ligandmolekül lässt sich in der Regel nur ein Farbstoffmolekül anbinden und die Farbstoffe neigen bei längerer Belichtung zur Degeneration (Photobleichung). Diese Nachteile schränken die Anwendung organischer Farbstoffe zum Teil erheblich ein. Eine Alternative dazu sind Quantenpunkte (engl. quantum dots) aus Halbleitermaterialien, die diese Nachteile nicht aufweisen,[27] dafür aber sehr bedenkliche Elemente, wie beispielsweise Arsen, Selen oder Cadmium, enthalten können, die eine In-vivo-Anwendung im Menschen prinzipiell ausschließen.
Die Plasmahalbwertszeit für Indocyaningrün beträgt lediglich 3 bis 4 Minuten.[28] Für viele Anwendungen ist dies ein zu geringer Wert. Durch die Verkapslung in Mizellen lässt sich die Plasmahalbwertszeit von ICG deutlich erhöhen.[29]
Potenzielle Anwendungen
Neben dem vielseitigen präklinischen Einsatz der Fluoreszenztomographie, wird intensiv an der Anwendung dieses Verfahrens in der humanen Diagnostik gearbeitet. Ein Schwerpunkt ist dabei die In-vivo-Diagnostik von Krebs, speziell von Brustkrebs.[30] Die gute Zugänglichkeit der Brust für die Bildgebung und das meist oberflächennahe Auftreten von Tumoren sind für die Fluoreszenztomographie günstig. Da es sich zudem um ein Verfahren ohne ionisierende Strahlung handelt, sind von dieser Seite keine langfristigen Folgeschäden zu erwarten, wie sie beispielsweise bei der Mammographie immer wieder diskutiert werden (Strahlenbelastung).[31][32] Die Fluoreszenzmammographie hat das Potenzial für ein schnelles und kostengünstiges Screeningverfahren bei Brustkrebs.[33][34][14][35][36] Die Schering AG stellte 2000 ein mit zwei Glucosamin-Molekülen modifiziertes Indocyaningrün (Bezeichnung NIR-1) als potenzielles Kontrastmittel für die NIR-Mammographie vor. Es handelt sich um ein unspezifisch bindendes Kontrastmittel. Für die Anwendung im Menschen liegt bisher noch keine Zulassung vor. Eine ähnliche Substanz ist KC 45.[37] 2007 wurden vielversprechende Ergebnisse mit einem speziellen Fluoreszenzbiomarker veröffentlicht, mit dem Mikrokalk, eine typische Ablagerung von malignen Brusttumoren, sichtbar gemacht werden kann.[38][39][40] Von der Geräteseite sind mittlerweile Prototypen von Kleingeräten zur Brustkrebs-Diagnose (hand-held probes) verfügbar.[41]
Auch zur Bildgebung des Lymphflusses[42] und zur Beurteilung des Wächterlymphknotens[43] ist die Fluoreszenztomographie prinzipiell geeignet.[44]
Die Fluoreszenztomographie könnte auch zur Stratifizierung von Patienten (stratifizierte Medizin, stratified medicine) speziell in der Onkologie eingesetzt werden. Dabei wird ermittelt, ob der Tumor eines Patienten bestimmte Stratifizierungsmarker (beispielsweise HER2/neu) exprimiert und die Therapie (im Beispiel Trastuzumab), überhaupt indiziert ist.[45][46]
Ein eleganter Ansatz ist die Verwendung von Fluorophor-Polymer-Konjugaten, die erst durch die Katalyse von bestimmten Enzymen, die vor allem in Tumorzellen überexprimiert sind, zur Fluoreszenz aktiviert werden. Zuvor war die Fluoreszenz gelöscht.[47][48]
Auch für die frühzeitige Erkennung einer rheumatoiden Arthritis werden neuartige Marker für die Fluoreszenztomographie entwickelt. Mit der konventionellen Röntgendiagnostik wird dieses Krankheitsbild meist in einem schon sehr weit fortgeschrittenen Stadium diagnostiziert. Eine frühzeitigere Diagnosestellung kann sich positiv auf die Behandlungsmöglichkeiten und den -erfolg auswirken.[49][50][51]
Stärken und Schwächen der Fluoreszenztomographie
Die Fluoreszenztomographie ist ein hochsensitives Verfahren, mit dem bereits kleinste Mengen eines geeigneten Fluorophors detektiert werden können. Die Sensitivität reicht an die von nuklearmedizinischen Verfahren, wie beispielsweise PET oder SPECT heran und ist der Magnetresonanztomographie (MRT) weit überlegen. Das Verfahren ist – verglichen mit anderen Tomographieverfahren – vergleichsweise preiswert; sowohl in den Geräteinvestitionen, dem Gerätebetrieb (Betriebsmittelkosten), als auch in der Durchführung eines Scans. Das Verfahren kommt ohne Strahlenbelastung aus und ist zur Darstellung von Strukturen und Funktionen geeignet.
Nachteilig ist der geringe Informationsgehalt, der durch Streueffekte bedingt ist. Mit zunehmender Gewebetiefe nimmt dieses Problem zu und die erzielbare Ortsauflösung nimmt drastisch ab, wobei Fettgewebe den Effekt zusätzlich verstärkt.[52] Bei größeren Tieren oder gar beim Menschen, lassen sich innere Organe derzeit nicht in einer brauchbaren Form darstellen.
Siehe auch
Weiterführende Literatur
- S. J. Erickson u. a.: Two-dimensional Fast Surface Imaging Using a Handheld Optical Device: In Vitro and In Vivo Fluorescence Studies. In: Transl Oncol 3, 2010, S. 16–22. PMID 20165691, PMC 2822449 (freier Volltext)
- N. Blow: In vivo molecular imaging: the inside job. In: Nature Methods 6, 2009, S. 465–469. doi:10.1038/nmeth0609-465
- D. Unholtz: Optische Oberflächensignalmessung mit Mikrolinsen-Detektoren für die Kleintierbildgebung. Dissertation, TH Karlsruhe, KIT Scientific Publishing, 2009, ISBN 3-86644-423-0 (eingeschränkte Vorschau in der Google-Buchsuche)
- S. Lee u. a.: Activatable imaging probes with amplified fluorescent signals. In: Chem Commun (Camb) 36, 2008, S. 4250–4260. PMID 18802536 (Review)
- N. Tischer: Molekulare in vivo Fluoreszenzbildgebung zur Darstellung von ErbB/Her2- und CCK2-rezeptorpositiven Tumoren im Tiermodell. Dissertation, Universität Marburg, 2008
- Pöschinger, Thomas; Janunts, Edgar; Brünner, H; Langenbucher, Achim: Systemkonzept für die berührungslose optische Fluoreszenztomographie an Kleintieren., Dreiländertagung Medizinphysik 2007 (in Bildgebende Systeme), TH.SS.B5.06 (2007)
- F. Ließmann: Zeitaufgelöste Fluoreszenzbildgebung für die Tumordiagnostik. Dissertation, LMU München, 2005
- B. Ballou u. a.: Fluorescence imaging of tumors in vivo. In: Curr Med Chem 12, 2005, S. 795–805. PMID 15853712 (Review)
- R. Haag: Neue potentielle NIR-Fluoreszenzfarbstoffe zur optischen Bildgebung: Charakter, Stabilität und Zytotoxizität. (PDF; 7,1 MB) Dissertation, Friedrich-Schiller-Universität Jena, 2005
- X. Intes und B. Chance: Non-PET functional imaging techniques: optical. In: Radiol Clin North Am 43, 2005, S. 221–234. PMID 15693658 (Review)
- C. Bremer u. a.: Fortschritte in der optischen Bildgebung. In: Der Radiologe 41, 2001, S. 131–137. doi:10.1007/s001170050955
- O. Dössel: Bildgebende Verfahren in der Medizin. Verlag Springer, 1999, ISBN 3-540-66014-3, S. 260f. (eingeschränkte Vorschau in der Google-Buchsuche)
Einzelnachweise
- E. E. Graves u. a.: Singularvalue analysis and optimization of experimental parameters in fluorescence molecular tomography. In: Journal of the Optical Society of America A 21, 2004, S. 231–241. PMID 14763766
- V. Ntziachristos u. a.: Visualization of antitumor treatment by means of fluorescence molecular tomography with an Annexin V-Cy5.5 conjugate. In: PNAS 101, 2004, S. 12294–12299. PMID 15304657, PMC 514472 (freier Volltext)
- M. J. Eppstein u. a.: Threedimensional, bayesian image reconstruction from sparse and noisy data sets: Near-infrared fluorescence tomography. In: PNAS 99, 2002, S. 9619–9624. PMID 12105269, PMC 124950 (freier Volltext)
- A. Joshi u. a.: Plane-wave fluorescence tomography with adaptive finite elements. In: Optics Letters 31, 2006, S. 193–195. PMID 16441027
- A. D. Klose and H. Hielscher u. a.: Fluorescence tomography with simulated data based on the equation of radiative transfer. In: Optics Letters 28, 2003, S. 1019–1021. PMID 12836765
- A. Godavarty u. a.: Diagnostic imaging of breast cancer using fluorescence-enhanced optical tomography: phantom studies. In: J Biomed Opt 9, 2004, S. 488–496. PMID 15189086
- A. B. Milstein u. a.: Fluorescence optical diffusion tomography. In: Applied Optics 42, 2003, S. 3081–3094. PMID 12790460
- R. B. Schulz: Entwicklung eines berührungsfrei arbeitenden Fluoreszenztomographiesystems mit angepassten Rekonstruktionsalgorithmen. Dissertation, Universität Heidelberg, 2006
- Sonu Bhaskar, Furong Tian, Tobias Stoeger, Wolfgang Kreyling, Jesús M de la Fuente, Valeria Grazú, Paul Borm, Giovani Estrada, Vasilis Ntziachristos und Daniel Razansky: Multifunctional Nanocarriers for diagnostics, drug delivery and targeted treatment across blood-brain barrier: perspectives on tracking and neuroimaging. In: Particle and Fibre Toxicology 2010, 7:3 doi:10.1186/1743-8977-7-3 PMID 20199661 (Review-Artikel im Open Access)
- Cynthia S Snyder, Sharmeela Kaushal, Yuko Kono, Hop S Tran Cao, Robert M Hoffman und Michael Bouvet: Complementarity of ultrasound and fluorescence imaging in an orthotopic mouse model of pancreatic cancer. In: BMC Cancer 2009, 9:106 doi:10.1186/1471-2407-9-106 PMID 19351417 (Open Access)
- Liat Goldshaid, Efrat Rubinstein, Alexander Brandis, Dadi Segal, Noa Leshem, Ori Brenner, Vyacheslav Kalchenko, Doron Eren, Tamar Yecheskel, Yoseph Salitra, Yoram Salomon und Avigdor Scherz: Novel design principles enable specific targeting of imaging and therapeutic agents to necrotic domains in breast tumors. In: Breast Cancer Research 2010, 12:R29 doi:10.1186/bcr2579 (Open Access)
- Y. T. Lim u. a.: Selection of quantum dot wavelengths for biomedical assays and imaging. In: Mol Imaging 2, 2003, S. 50–64. PMID 12926237
- V. Ntziachristos u. a.: Looking and listening to light: the evolution of whole-body photonic imaging. In: Nature Biotechnology 23, 2005, S. 313–320. PMID 15765087
- D. J. Hawrysz und E. M. Sevick-Muraca: Developments toward diagnostic breast cancer imaging using near-infrared optical measurements and fluorescent contrast agents. In: Neoplasia 2, 2000, S. 388–417. PMID 11191107, PMC 1507982 (freier Volltext)
- U. Haberland u. a.: Optische Tomographie: Neue bildgebende Verfahren in der Medizintechnik. In: Proceedings des Aachener Workshops am Institut für Medizinische Informatik und Biometrie der RWTH Aachen vom 8. und 9. November 1996
- J. V. Frangioni: In vivo near-infrared fluorescence imaging. In: Curr Opin Chem Biol 7, 2003, S. 626–634. PMID 14580568 (Review)
- Y. Hama u. a.: In vivo spectral fluorescence imaging of submillimeter peritoneal cancer implants using a lectin-targeted optical agent. In: Neoplasia 8, 2006, S. 607–612. PMID 16867223, PMC 1601930 (freier Volltext)
- E. E. Graves u. a.: A submillimeter resolution fluorescence molecular imaging system for small animal imaging. In: Medical Physics 30, 2003, S. 901–911. PMID 12772999
- L. P. Kamolz u. a.: Indocyanine green video angiographies help to identify burns requiring operation. In: Burns 29, 2003, S. 785–791. PMID 14636752
- S. Achilefu u. a.: Novel receptor-targeted fluorescent contrast agents for in vivo tumor targeting. In: Investigative Radiology 35, 2000, S. 479–485. PMID 10946975
- A. Becker u. a.: Receptor-targeted optical imaging of tumors with near-infrared fluorescent ligands. In: Nature Biotechnology 19, 2001, S. 327–331. PMID 11283589
- J. E. Bugaj u. a.: Novel fluorescent contrast agents for optical imaging of in vivo tumors based on a receptor-targeted dye-peptide conjugate platform. In: J Biomed Opt 6, 2001, S. 122–133. PMID 11375721
- S. Ke u. a.: Near-infrared optical imaging of epidermal growth factor receptor in breast cancer xenografts. In: Cancer Res 63, 2003, S. 7870–7875. PMID 14633715
- J. Zhang u. a.: Fluorescent quantum dot-labeled aptamer bioprobes specifically targeting mouse liver cancer cells. In: Talanta 81, 2010, S. 505–509. PMID 20188954
- Y. Wu u. a.: DNA aptamer-micelle as an efficient detection/delivery vehicle toward cancer cells. In: PNAS 107, 2010, S. 5–10. PMID 20080797
- T. Deng u. a.: A sensitive fluorescence anisotropy method for the direct detection of cancer cells in whole blood based on aptamer-conjugated near-infrared fluorescent nanoparticles. In: Biosens Bioelectron 25, 2010, S. 1587–1591. PMID 20022484
- W. C. Chan und S. Nie: Quantum dot bioconjugates for ultrasensitive nonisotopic detection. In: Science 281, 1998, S. 2016–2018. PMID 9748158
- A. K. Kirchherr u. a.: Stabilization of indocyanine green by encapsulation within micellar systems. In: Mol Pharm 6, 2009, S. 480–491. PMID 19228053
- T. H. Kim, Y. Chen, C. W. Mount, W. R. Gombotz, X. Li, S. H. Pun: Evaluation of temperature-sensitive, indocyanine green-encapsulating micelles for noninvasive near-infrared tumor imaging. In: Pharm. Res. 27, 2010, S. 1900–1913 PMID 20568000.
- N. Kosaka u. a.: Clinical implications of near-infrared fluorescence imaging in cancer. In: Future Oncol 5, 2009, S. 1501–1511. PMID 19903075 (Review)
- B. Ebert u. a.: Near-infrared fluorescent dyes for enhanced contrast in optical mammography: phantom experiments. In: J Biomed Opt 134, 2001, S. 134–140. doi:10.1117/1.1350561 PMID 11375722
- S. G. Demos u. a.: Advances in optical spectroscopy and imaging of breast lesions. In: J Mammary Gland Biol Neoplasia 11, 2006, S. 165–181. PMID 17091396 (Review)
- B. Alacam u. a.: Pharmacokinetic-rate images of indocyanine green for breast tumors using near-infrared optical methods. In: Physics in Medicine and Biology 53, 2008, S. 837–859. PMID 18263944
- S. Nioka und B. Chance: NIR spectroscopic detection of breast cancer. In: Technol Cancer Res Treat 4, 2005, S. 497–512. PMID 16173821
- B. J. Tromberg u. a.: Assessing the future of diffuse optical imaging technologies for breast cancer management. In: Medical Physics 35, 2008, S. 2443–2451. PMID 18649477, PMC 2809725 (freier Volltext)
- C. Li u. a.: Glucosamine-bound near-infrared fluorescent probes with lysosomal specificity for breast tumor imaging. In: Neoplasia 10, 2008, S. 389–398. PMID 18392136, PMC 2288541 (freier Volltext)
- D. von Stieglitz: Nachweis einer Arthritis im Sprunggelenk der Ratte mittels NIR Bildgebung unter Verwendung des Farbstoffes KC 45 und deren Korrelation mit der MRT und histologischen Untersuchung. Dissertation, FU Berlin, 2004.
- J. V. Frangioni u. a.: Synthesis of Conjugatable Bisphosphonates for Molecular Imaging of Large Animals. In: Angewandte Chemie International Edition 46, 2007, S. 7969–7971. PMID 17868163, PMC 2440667 (freier Volltext)
- Neues Kontrastmittel für Brustkrebs-bedingte Mikroverkalkungen. Vom 23. Oktober 2007
- K. R. Bhushan u. a.: Detection of breast cancer microcalcifications using a dual-modality SPECT/NIR fluorescent probe. In: Journal of the American Chemical Society 130, 2008, S. 17648–17649. PMID 19055348, PMC 2696399 (freier Volltext)
- J. Ge u. a.: Three-dimensional fluorescence-enhanced optical tomography using a hand-held probe based imaging system. In: Medical Physics 35, 2008, S. 3354–3363. doi:10.1118/1.2940603 PMID 18697559, PMC 2562618 (freier Volltext)
- E. M. Sevick-Muraca u. a.: Imaging of lymph flow in breast cancer patients after microdose administration of a near-infrared fluorophore: feasibility study. (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. In: Radiology 246, 2008, S. 734–741. PMID 18223125
- L. Sampath u. a.: Near infrared fluorescent optical imaging for nodal staging. In: J Biomed Opt 13, 2008, S. 041312. PMID 19021320 (Review)
- R. Sharma u. a.: New horizons for imaging lymphatic function. In: Ann N Y Acad Sci 1131, 2008, S. 13–36. PMID 18519956 (Review)
- L. Sampath u. a.: Dual-labeled trastuzumab-based imaging agent for the detection of human epidermal growth factor receptor 2 overexpression in breast cancer. In: J Nucl Med 48, 2007, S. 1501–1510. PMID 17785729
- M. S. Gee u. a.: Human breast cancer tumor models: molecular imaging of drug susceptibility and dosing during HER2/neu-targeted therapy. In: Radiology 248, 2008, S. 925–935. PMID 18647846, PMC 2798096 (freier Volltext)
- C. Bremer u. a.: In vivo molecular target assessment of matrix metalloproteinase inhibition. In: Nature Medicine 6, 2001, S. 743–748. PMID 11385514
- C. H. Tung u. a.: In vivo imaging of proteolytic enzyme activity using a novel molecular reporter. In: Cancer Res 60, 2000, S. 4953–4958. PMID 10987312
- Entwicklung eines neuartigen Verfahrens zur frühen Diagnose entzündlich rheumatischer Gelenkveränderungen mittels Laser-induzierter Fluoreszenz. (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.
- T. Fischer u. a.: Assessment of unspecific near-infrared dyes in laser-induced fluorescence imaging of experimental arthritis. In: Academic Radiology 13, 2006, S. 4–13. PMID 16399028
- U. J. Netz: Diffuse optische Tomographie an Fingergelenken für die Diagnose der rheumatoiden Arthritis. Dissertation, FU Berlin, 2008
- M. Pieper: Optische Tomographie – Ein kurzer Überblick. (Memento vom 29. April 2005 im Internet Archive) (PDF; 1,1 MB) Januar 2005
Weblinks
- Biomedizinische Fluoreszenzbildgebung mit Einzelphotonenempfindlichkeit (PDF; 1,3 MB) (TU Braunschweig)