Photosensibilisator (Chemie)
Der Photosensibilisator ist ein Stoff, dessen Absorptionsbereich genau im Wellenlängenbereich des mit einer Photolampe eingestrahlten Lichtes liegt (meist im UV-Bereich des Absorptionsspektrums), und als photochemischer „Katalysator“ wirken kann. Er überträgt die Lichtenergie auf ein zweites Molekül, das andere Absorptionseigenschaften hat, aber nach der Übertragung der Lichtenergie durch den Sensibilisator reagieren kann. Es können nämlich nur solche Lichtstrahlen photochemisch wirksam sein, welche von dem photochemisch umzusetzenden Stoff absorbiert werden.[1] Ein in der Natur vorkommende Sensibilisator ist beispielsweise Chlorophyll, das bei der Lichtreaktion der Photosynthese[2] im Photosystem I und II eine Rolle spielt. Sensibilisatoren können Anwendung finden bei der Arzneimittelsynthese zur Herstellung enantiomerenreiner Verbindungen und bei der Entwicklung neuer Methoden in der Onkologie zur Unterstützung der photodynamischen Therapie, z. B. bei Hautkrebs.[3] Sensibilisatoren lassen sich prinzipiell einteilen in Energietransfer- und Elektronentransfer-Sensibilisatoren.
Energietransfersensibilisatoren
Energietransfer über den Singulettenergiezustand
Substanzen, die ihren Absorptionsbereich im Bereich der eingestrahlten Wellenlänge haben, sind bevorzugt aromatische Verbindungen. Diese werden photochemisch angeregt und gelangen in einen höheren Energiezustand, den S2-Zustand. Von dort aus fällt das Molekül in einen energetisch tiefer liegenden Energiezustand S1, eine strahlungslose Deaktivierung. Danach kommt es zur Energietragung aus dem niedrigsten Energieniveau des Sensibilisators auf das höchste Energieniveau des Substrats. Das Substrat hat dann die notwendige Energie zum Ablauf einer photochemischen Reaktion, aus der sich das Zielmolekül bildet, das ohne Zusatz eines Sensibilisators nicht entstehen würde. Dadurch wird die Bandbreite der Einsatzmöglichkeiten photochemisch induzierter Reaktionen erhöht. Der Sensibilisator selbst ändert seine Struktur nicht. Energietransfersensibilisatoren sind nach ihrem Reaktionsmechanismus benannt, bei dem ein Donor D (der Sensibilisator) seine Energie auf einen Akzeptor A (das Substrat) überträgt, auch Förster-Resonanzenergietransfer genannt. Dabei kann der Energietransfer entweder über Singulett- oder über Triplettenergiezustände ablaufen. Es gilt hierbei die Kasha-Regel.
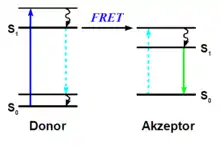
Energietransfer über den Triplettenergiezustand
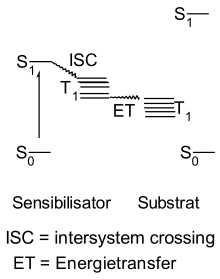
Beim Energietransfer gelangt der Sensibilisator durch Lichtabsorption in den S1 Energiezustand. Danach kommt es zum Intersystem Crossing, einem strahlungslosen Energieübergang zum Triplettenergiezustand. Der darauffolgende Energietransfer verläuft unter Energieabgabe aus dem Triplettzustand T1 des Sensibilisators an das Substrat, das sich ebenso im Triplettzustand befindet. Einen anschaulichen Überblick hierzu gibt das Jablonski-Termschema.
| Sensibilisator | Triplettenergie | Singulettenergie |
|---|---|---|
| Benzophenon | 287 | 319 |
| Naphthalin | 250 | 385 |
| Eosin | 178 | 230 |
| Bengalrosa | 65 | 214 |
| Porphyrin | ||
| Chlorophyll | ||
Elektronentransfersensibilisatoren
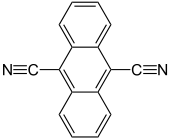
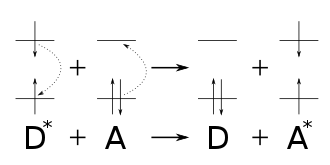
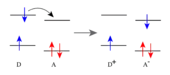
Bei der Sensibilisierung mit Elektronentransfer wird ein Elektron vom Substrat auf den photochemisch induzierten (angeregten) Sensibilisator übertragen. Hierfür eignen sich Sensibilisatoren mit guten Akzeptoreigenschaften, also hohem Reduktionspotential. Das bedeutet, auch hier braucht man ein aromatisches System, das die eingestrahlte Wellenlänge absorbieren kann, es soll aber gleichzeitig nach einer photochemischen Anregung reduzierend wirken. Dies ist bei Aromaten der Fall, die elektronegative Substituenten (beispielsweise CN) besitzen. Der Sensibilisator absorbiert Licht, gelangt in einen energetisch höheren Energiezustand und ist in der Lage, ein Elektron des Substrats aufzunehmen. Durch diesen Elektronentransfer erhält man ein Radikalionenpaar, wobei der Sensibilisator (in diesem Fall der Akzeptor(A)) zum Radikalanion wird, und das Substrat (in diesem Fall der Donor(D)) zum Radikalkation. Durch die photochemische Anregung entsteht nämlich beim Sensibilisator (Akzeptor) eine Elektronenlücke, so dass die Aufnahme eines Elektrons erleichtert wird und damit die Bildung eines Radikalanions. Gleichzeitig wird der Elektronendonor zum Radikalkation. Je nach Lösungsmittelpolarität sind diese Radikalionenpaare unterschiedlich stark solvatisiert, das heißt von einer Lösungsmittelhülle umgeben.[4] Bei der daraus resultierenden photochemische Reaktion erhält man andere Produktverhältnisse als bei Energietransfersensibilisatoren.
Beispiele für sensibilisierte Photoreaktionen
- cis-trans-Isomerisierung von 1,2-Diphenylcyclopropan
- Dimerisierung von 1,3-Cyclohexadien
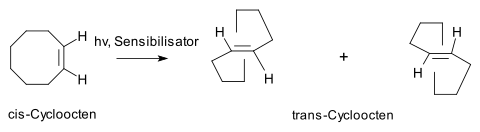
- cis-trans-Isomerisierung von Cycloocten:
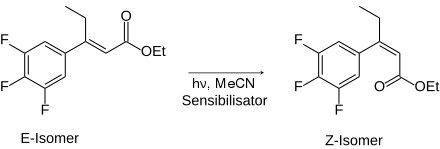
- Isomerisierung eines Zimtsäurederivats:
- Die diastereoselektive E-/Z-Isomerisierung verläuft unter Zusatz von (−)-Riboflavin als Sensibilisator.[5][6]
Chirale Sensibilisatoren
Ein aktuelles Forschungsgebiet ist die Entwicklung chiraler Sensibilisatoren, die es ermöglichen, enantiodifferenzierende Photoreaktionen durchzuführen. Hierzu eignen sich Moleküle mit axialem Chiralitätszentrum wie substituierte Binaphthyle. Auch substituierte Triptycene oder Moleküle mit helikaler Chiralität, wie beispielsweise Pentahelicendinitril[7] könnten als Sensibilisatoren Anwendung finden.
Ein bekanntes Beispiel für einen chiralen Elektronentransfersensibilisator ist 2,2'-Dicyano-1,1'-binaphthyl.
Literatur
- H.G.O. Becker: Einführung in die Photochemie. Deutscher Verlag der Wissenschaften, 1991, ISBN 3-326-00604-7.
- N.J. Turro: Modern Molecular Photochemistry. Menlo Park, 1978, S. 296–358.
- A. Gilbert, J. Baggott: Essentials of Molecular Photochemistry. Oxford Blackwill Scientific Publications, 1991, ISBN 0-632-02429-1.
- M. Klessinger, J. Michl: Lichtabsorption und Photochemie organischer Moleküle. Weinheim, New York, 1989.
- M. Vondenhof: Untersuchungen zur chiralen Diskriminierung bei Photoreaktionen. Dissertation, RWTH Aachen, 1990.
- Martin Vondenhof, Jochen Mattay: Radical ions and photochemical charge transfer phenomena, 28. 1,1′-Binaphthalene-2,2′-dicarbonitrile in photochemically sensitized enantiodifferentiating isomerizations. In: Chemische Berichte. 123, Nr. 12, 1990, S. 2457–2459, doi:10.1002/cber.19901231232.
- Ji In Kim, Gary B. Schuster: Enantioselective catalysis of the triplex Diels-Alder reaction: a study of scope and mechanism. In: Journal of the American Chemical Society. 114, Nr. 24, 1992, S. 9309–9317, doi:10.1021/ja00050a011.
- Mark M. Maturi, Thorsten Bach: Enantioselective Catalysis of the Intermolecular [2+2] Photocycloaddition between 2-Pyridones and Acetylenedicarboxylates. In: Angewandte Chemie International Edition. 53, Nr. 29, 2014, S. 7661–7664, doi:10.1002/anie.201403885.
- G. Fukuhara, T.Mori, T.Wada and Y.Inoue: The first supramolecular photosensitization of enantiodifferentiating bimolecular reaction: anti-Markovnikov photoaddition of methanol to 1,1-diphenylpropene sensitized by modified β-cyclodextrin In. Chem. Commun. 2006, S. 1712–1714. doi:10.1039/B601674J.
- A. Seeber: Synthese neuer Elektronentransfer- und Energietransfer-Sensibilisatoren und deren Anwendung in Photoreaktionen. Dissertation 1995.
- Huanhuan Fan, Guobei Yan, Zilong Zhao, Xiaoxiao Hu, Wenhan Zhang, Hui Liu, Xiaoyi Fu, Ting Fu, Xiao-Bing Zhang and Weihong Tan: A Smart Photosensitizer–Manganese Dioxide Nanosystem for Enhanced Photodynamic Therapy by Reducing Glutathione Levels in Cancer Cells. Angewandte Chemie, 2016, 128, S. 1–7, doi:10.1002/ange.201510748.
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 1020.
- W. Nultsch: Allgemeine Botanik. 1986, ISBN 3-13-383308-1, S. 253–263.
- Willem A. Velema, Wiktor Szymanski, Ben L. Feringa: Photopharmacology: Beyond Proof of Principle. In: Journal of the American Chemical Society. 136, Nr. 6, 2014, S. 2178–2191, doi:10.1021/ja413063e.
- Jochen Mattay, Martin Vondenhof: Contact and solvent-separated radical Ion Pairs in Organic Photochemistry. In: Jochen Mattay (Hrsg.): Photoinduced Electron Transfer III. (= Topics in Current Chemistry. Band 159). Springer, Berlin/Heidelberg 1991, ISBN 3-540-53257-9, S. 219–255.
- Thorsten Bach: Trendberichte: Organische Chemie 2015. In: Nachrichten aus der Chemie 64, März 2016, S. 277.
- Jan B. Metternich, Ryan Gilmour: A Bio-Inspired, Catalytic E → Z Isomerization of Activated Olefins. In: Journal of the American Chemical Society. Band 137, Nr. 35, 2015, S. 11254–11257, doi:10.1021/jacs.5b07136.
- Helmut Görner, Christian Stammel, Jochen Mattay: Excited state behaviour of pentahelicene dinitriles. In: Journal of Photochemistry and Photobiology A: Chemistry. Band 120, Nr. 3, Februar 1999, S. 171–179, doi:10.1016/S1010-6030(98)00423-7.