Propin
Propin (Methylacetylen) ist ein ungesättigter, aliphatischer Kohlenwasserstoff aus der homologen Reihe der Alkine mit der Summenformel C3H4. Es ist ein farbloses, hochentzündliches Gas. Für Lagerung und Transport wird Propin komprimiert, es muss dabei stabilisiert werden.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
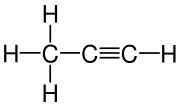 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Propin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3H4 | |||||||||||||||
| Kurzbeschreibung |
farbloses, fast geruchloses, betäubend wirkendes Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 40,06 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−23,2 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,3863 (−40 °C)[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Herstellung
Propin kann durch die Dehydrohalogenierung von Dihalogenpropanen[7] oder 2-Halogenpropenen[8] gewonnen werden. Es kann auch durch Isomerisierung von Allen in Gegenwart von Basen hergestellt werden.[9] Technisch wird das Gas aus der C3-Fraktion von Crackgasen mittels Lösungsmittelextraktion gewonnen.[10][11]
Eigenschaften
Physikalische Eigenschaften
Propin schmilzt bei −102,7 °C und siedet bei −23,2 °C. Es hat einen charakteristischen Geruch. Es ist schwerer als Luft. Mit einer positiven molaren Bildungswärme von 183,4 kJ/mol handelt es sich um eine endotherme Verbindung.[12] In Wasser ist es nahezu unlöslich. In Alkoholen ist es gut löslich.
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in kPa, T in K) mit A = 4,95219, B = 1226,123 und C = −1,926 im Temperaturbereich von 161,5 K bis 254,3 K[13] bzw. mit A = 4,03069, B = 818,384 und C = −46.457 im Temperaturbereich von 249,8 K bis 398 K[14].
Wichtige thermodynamische Eigenschaften sind in der folgenden Tabelle aufgelistet:
| Eigenschaft | Typ | Wert [Einheit] |
|---|---|---|
| Standardbildungsenthalpie | ΔfH0gas | 183,4 kJ·mol−1[12] |
| Standardverbrennungsenthalpie | ΔcH0gas | 1938,94 kJ·mol−1[15] |
| Wärmekapazität | cp | 60,73 J·mol−1·K−1 (25 °C)[16] als Gas |
| Tripelpunkt | Ttriple | 168,5 K[17] |
| Kritische Temperatur | TC | 402,4 K[18] |
| Kritischer Druck | PC | 56,3 bar[18] |
| Kritisches Volumen | VC | 0,1635 l·mol−1[18] |
| Kritische Dichte | ρC | 6,12 mol·l−1[18] |
Chemische Eigenschaften
An der sehr reaktiven Dreifachbindung finden vor allem Additionsreaktionen statt. Wie alle endständigen Alkine besitzt Propin schwach saure Eigenschaften.
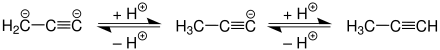
Mit starken Basen kann aber auch ein Dianion erzeugt werden.[19]
Durch Umsetzung mit Alkylhalogeniden ergeben sich 2-Alkine. So erhält man durch die Reaktion von Propin mit Methyliodid 2-Butin (Dimethylacetylen).[7]
Propin steht im Gleichgewicht mit Propadien:
H3C−C≡CH ⇌ H2C=C=CH2
Sicherheitstechnische Kenngrößen
Propin bildet leicht entzündliche Gas-Luft-Gemische. Der Explosionsbereich liegt zwischen 1,8 Vol.‑% (38 g/m3) als untere Explosionsgrenze (UEG) und 16,8 Vol.‑% (280 g/m3) als obere Explosionsgrenze (OEG). Die Mindestzündenergie beträgt 0,11 mJ.[20] Die Grenzspaltweite wurde mit 0,74 mm bestimmt. Es resultiert damit eine Zuordnung in die Explosionsgruppe IIB. Die Zündtemperatur beträgt 340 °C. Der Stoff fällt somit in die Temperaturklasse T2.[21] Analog zum Acetylen neigt Propin als endotherme Verbindung zum explosiven Selbstzerfall bei höheren Temperaturen und Drücken.[22]
Verwendung
Propin kann zusammen mit seinem Isomer Propadien (Allen) als Schweiß- und Schneidgas (MAPP-Gas) verwendet werden. Es ist weiterhin ein wichtiges Zwischenprodukt in der organischen Synthese, z. B. für die Herstellung von Vinylverbindungen.
Weblinks
Einzelnachweise
- Eintrag zu Propin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. November 2014.
- Eintrag zu Propin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Samuel H. Yalkowsky, Yan He, Parijat Jain: Handbook of Aqueous Solubility Data, Second Edition. CRC Press, 2016, ISBN 978-1-4398-0246-5, S. 47 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hans-Dieter Jakubke, Ruth Karcher (Koordinatoren): Lexikon der Chemie in drei Bänden, Spektrum Verlag, Heidelberg, Band 3, 1999, ISBN 3-8274-0381-2, S. 105.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-446.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 74-99-7 bzw. Propin), abgerufen am 2. November 2015.
- G. B. Heisig, H. M. Davis: Physical Constants of Dimethylacetylene. In: J. Amer. Chem. Soc. 57, 1935, S. 339–340. doi:10.1021/ja01305a031.
- C. Friedel; L.: J. Liebigs Ann. Chem. 134 (1865) 263.
- J. F. Cordes, H. Günzler: Propin/Propadien-Umlagerung an Aktivkohle. In: Zeitschrift für Naturforschung B. 15, 1960, S. 682 (online).
- D. Sohns: Linde Reports Science and Technology. 30, 1979, S. 21.
- Linde AG: US 4 701 190 (1986), EP 0 224 748 (1986).
- D. D. Wagman, J. E. Kilpatrick, K. S. Pitzer, F. D. Rossini: Heats, equilibrium constants, and free energies of formation of the acetylene hydrocarbons through the pentynes, to 1,500° K. In: J. Res. NBS. 35, 1945, S. 467–496.
- W. A. van Hook: Vapor Pressures of the Methylacetylenes, H3CCCH, H3CCCD, D3CCCH, and D3CCCD. In: J. Chem. Phys. 46, 1967, S. 1907–1918.
- D. R. Stull: Vapor Pressure of Pure Substances – Organic Compounds. In: Ind. Eng. Chem. 39, 1947, S. 517–540. doi:10.1021/ie50448a022.
- Buckl, K.; Meiswinkel, A.: Propyne, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2008; doi:10.1002/14356007.m22_m01.
- Selected Values of Properties of Chemical Compounds. Thermodynamics Research Center, Texas A&M University, College Station, Texas, 1997.
- O. Maass, C. H. Wright: Some physical properties of hydrocarbons containing two and three carbon atoms. In: J. Am. Chem. Soc. 43, 1921, S. 1098–1111.
- C. Tsonopoulos, D. Ambrose: Vapor-Liquid Critical Properties of Elements and Compounds. 6. Unsaturated Aliphatic Hydrocarbons. In: J. Chem. Eng. Data. 41, 1996, S. 645–656.
- K. P. C. Vollhardt, N. E. Schore: Organische Chemie. 4. Auflage. Wiley-VCH, 2007, ISBN 978-3-527-31380-8, S. 41.
- BG RCI-Merkblatt T 033 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen, Jedermann-Verlag, 2009, ISBN 978-3-86825-103-6.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- F. Fitzgerald: Decomposition of Methyl Acetylene. In: Nature. 186, 1960, S. 386–387. doi:10.1038/186386a0.

