Hägg-Diagramm
Das Hägg-Diagramm (engl. Hägg's diagram oder bjerrum plot nach Niels Janniksen Bjerrum), auch Speziierungsdiagramm (vgl. Speziierung) genannt, dient in der analytischen Chemie dazu, sich schnell einen Überblick über die Verhältnisse einer wässrigen Säure-, Base- oder Salzlösung bekannter Konzentration zu geben. Es liefert eine doppelt-logarithmische Darstellung der Konzentrationsverhältnisse eines konjugierten Säure-Base-Paares (d. h. der Konzentrationen der einzelnen chemischen Spezies) in Abhängigkeit vom vorliegenden pH-Wert und wird auch für Titrationen verwendet.
Die Darstellung geht auf den schwedischen Chemiker Gunnar Hägg zurück.
Prinzip und Konstruktion
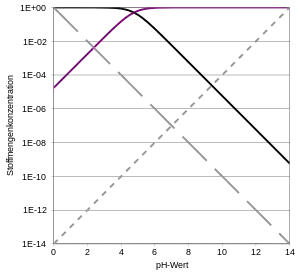
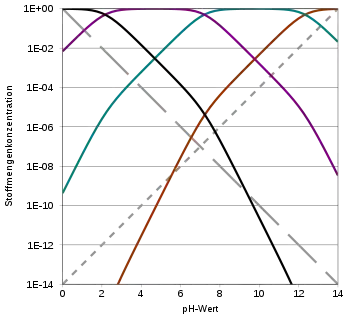
Im Vergleich zur einfach-logarithmischen Darstellung der regulären Titrationskurve, wo der Titrationsgrad gegen den pH-Wert aufgezeichnet ist, wird hier auch die betrachtete Konzentration logarithmiert, da sich die Konzentrationsänderungen bei Titrationen über viele Zehnerpotenzen erstrecken.
Auf der Abszisse wird der pH-Wert aufgetragen; auf der Ordinate der negative dekadische Logarithmus der Formalkonzentration des zu betrachtenden Stoffes. Man stellt das Massenwirkungsgesetz des gesuchten Säure-Base-Paares um und löst es so auf, dass die Konzentration von Säure und konjugierter Base nur noch von Säurekonstante, Hydronium-Konzentration und Anfangskonzentration abhängen. Nach dem Logarithmieren der erhaltenen Gleichungen erhält man Kurven mit schrägen und waagerechten Asymptoten, die sich für die Bereiche pH < pKs und pH > pKs leicht durch simple Geraden mit den Steigungen 0 und 1 annähern lassen. Für die Hydronium-Konzentration ergibt sich eine Ursprungsgerade, die Hydroxid-Konzentration ist entsprechend dazu orthogonal und schneidet sie im Neutralpunkt mit pH = 7, da hier beide Konzentrationen gleich sind. Mehrprotonige Säuren lassen sich einfach durch Aneinandersetzen der Hägg-Diagramme der einzelnen Protolysestufen erhalten; man geht hier von näherungsweise unabhängigen Gleichgewichten aus.
Markante Punkte bei der Titration
Die Näherungen des Hägg-Diagrammes sind verblüffend genau, lediglich für den Bereich ±1 pH-Einheit um den Punkt pH = pKs sinkt die Genauigkeit. Der pKs-Wert ist temperaturabhängig und gilt für unendliche Verdünnung; in praxi titriert man 0,001 bis 0,1 molare Lösungen bei 25 °C.
Markante Punkte lassen sich durch Betrachtungen der Gleichgewichte im Verlauf einer fiktiven Titration ablesen.
- So liegt am Anfang nur die Konzentration der Säure vor, diese bestimmt den pH-Wert der Lösung, indem sie in konjugierte Base und Proton dissoziiert. Dementsprechend liegt der Anfangspunkt am Schnittpunkt der Geraden von Basen- und Hydronium-Konzentration.
- Am Pufferpunkt liegen gleiche Konzentrationen von Säure und konjugierter Base vor, sodass auch hier einfach der entsprechende Schnittpunkt herangezogen werden kann.
- Am Äquivalenzpunkt liegt nur noch konjugierte Base vor; diese zerfällt mit Wasser zu Hydroxid und Säure, den pH-Wert liefert der Schnittpunkt dieser Konzentrationsgeraden.
Darüber hinaus sind weitere Aussagen über die Titriergenauigkeit, also den Dissoziationsgrad der konjugierten Base am Äquivalenzpunkt, sowie über weitere Konzentrationsverhältnisse für jeden beliebigen pH-Wert möglich.
Hierzu liest man an den entsprechenden Punkten den Logarithmus ab und berechnet daraus die vorliegende Konzentration.
Umgekehrt logarithmiert man bei gesuchten pH-Werten das vorliegende Konzentrationsverhältnis (z. B. 90 % Titration: nur noch 10 % der ursprünglichen Säurekonzentration sind vorhanden) in den Logarithmus um und ermittelt so graphisch den gesuchten pH-Wert.
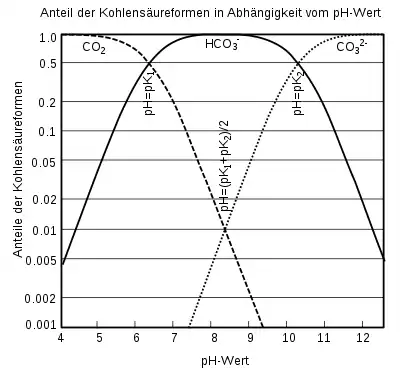
Andere Anwendungen des Hägg-Diagrammes
Die doppelt-logarithmische Darstellung lässt sich nicht nur für Protolyse-Gleichgewichte verwenden, sondern theoretisch auf alle Gleichgewichtssysteme, also auch Redox- und Löslichkeitsgleichgewichte übertragen. Es ergeben sich ähnlich einfach zu konstruierende Schaubilder.
- Für Redoxgleichgewichte trägt man statt des pH-Wertes das Redox-Potential auf der Abszisse auf; die analogen Gleichungen ergeben sich aus der logarithmischen Umstellung der Nernstschen Gleichung.
- Beispielsweise für die simultane argentometrische Titration von Halogeniden und Pseudohalogeniden lässt sich ebenfalls ein Hägg-Diagramm formulieren; auf der Abszisse wird die logarithmierte Silberkonzentration aufgetragen; die Gleichungen ergeben sich aus der Logarithmierung der Löslichkeitsgleichgewichte.
Siehe auch
Literatur
- Udo R. Kunze: Grundlagen der quantitativen Analyse. Thieme Verlag, Stuttgart 1990, ISBN 3-13585-803-0.
Weblinks
- Heiner Grimm, Clausthal-Zellerfeld: pH-Wert in Wasser und wäßrigen Lösungen (Säuren, Basen, Salze, Salzgemische): ph-Berechnung und Ermittlung des pH mit dem Hägg-Diagramm. Abgerufen am 15. Jan. 2009, (Seite mit umfangreichen Erläuterungen zu Hägg-Diagrammen).