Erlenmeyer-Regel
Die Erlenmeyer-Regel wurde von Emil Erlenmeyer formuliert und besagt, dass organisch-chemische Verbindungen, die an einem Kohlenstoffatom mehr als eine Hydroxygruppe (–OH) tragen, nicht stabil sind, sondern zur Abspaltung von Wasser neigen.
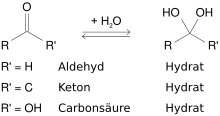
Stoffe mit zwei (Keton- oder Aldehydhydrate), mit drei (Orthocarbonsäuren) oder mit vier (Orthokohlensäure) Hydroxygruppen am selben C-Atom sind im Allgemeinen instabil. Ursache ist die höhere Bindungsenergie einer Kohlenstoff-Sauerstoff-Doppelbindung gegenüber zwei C-O-Einfachbindungen und die gegenseitige Abstoßung der räumlich beieinander liegenden Sauerstoffatome. Beispiele für die Erlenmeyer-Regel sind die Hydrate von Carbonylverbindungen, wie von Aldehyden [RCH(OH)2], von Ketonen [R2C(OH)2] oder von Carbonsäuren [RC(OH)3], die normalerweise nicht als Substanz isolierbar sind. Das Gleichgewicht ihrer Bildung aus der Carbonylverbindung und Wasser liegt üblicherweise weit auf Seite der Edukte. Zum Teil trifft dies auf die Kohlensäure zu, die als Hydrat von Kohlenstoffdioxid sehr leicht wieder zerfällt.
Derivate geminaler Diole oder Triole sind aber immer dann stabil, wenn alle Wasserstoffatome der Hydroxygruppen substituiert sind, da sie sich nicht mehr durch einfache Protolyse in die stabileren Carbonylverbindungen umwandeln können. Zu diesen Verbindungen zählen die Acetale (im engeren Sinne sowie Ketale) R2C(OR')2, die Kohlensäureester, Carbaminsäureester und die Orthocarbonsäureester [RC(OR')3]. Ebenso sind Orthokohlensäureester (Tetraalkoxymethane) bekannt und stabil.[1]
Die Erlenmeyer-Regel lässt sich außer auf Hydroxygruppen auch auf andere Substituenten anwenden. Bei Aminogruppen sind Aminale häufig instabil, während geminal halogenierte Alkohole leicht zu Carbonylverbindungen und den entsprechenden Halogenwasserstoffen zerfallen.[2]
Ausnahmen
Ausnahmen bilden lediglich Verbindungen, die in alpha-Stellung stark elektronenziehende Gruppen besitzen, wie Chloralhydrat, Glyoxylsäure oder Ninhydrin. Formaldehyd liegt in wässriger Lösung praktisch vollständig als Hydrat vor, ist aber nur in Lösung beständig und lässt sich – im Gegensatz zu Chloralhydrat und Ninhydrin – nicht als Substanz isolieren. Auch Halbacetale sind nur ausnahmsweise stabil. Dazu zählen solche, die sich von Aldehyden oder Ketonen mit stark elektronenanziehenden Gruppen ableiten, aber auch cyclische Halbacetale, wie Glucose sind stabil. Tetrodotoxin folgt als Orthocarbonsäure-diester nicht der Erlenmeyer-Regel, sondern ist durch die Bildung zweier Ringe stabilisiert.
Acidiumionen sind wegen der mesomeriestabilisierten positiven Ladung keine geminalen Diole und stellen nur formal eine Verletzung der Erlenmeyer-Regel dar.
Einzelnachweise
- Eintrag zu Orthoester. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. Juni 2014.
- Louis Fieser und Mary Fieser: Organische Chemie, 2. Auflage, Verlag Chemie 1982, ISBN 3-527-25075-1.