Hydroxyiminocyanessigsäureethylester
Hydroxyiminocyanessigsäureethylester (Oxyma) ist das Oxim des Cyanessigsäureethylesters und findet Verwendung als Additiv für Carbodiimide, wie z. B. Dicyclohexylcarbodiimid (DCC) bei der Peptidsynthese. Dabei fungiert es aufgrund seiner ausgeprägten Acidität (pKS 4,60) als Neutralisierungsreagens für die Basizität bzw. Nukleophilie des DCC und unterdrückt baseninduzierte Nebenreaktionen, insbesondere die Racemisierung.[7]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
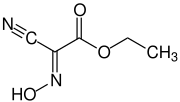 | |||||||||||||||||||
| Strukturformel des (E)-Isomers | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Hydroxyiminocyanessigsäureethylester | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H6N3O3 | ||||||||||||||||||
| Kurzbeschreibung |
grauweißer bis weißer[1] oder beiger kristalliner[2] Feststoff | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 142,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| pKS-Wert |
4,60[5] | ||||||||||||||||||
| Löslichkeit |
löslich in Dimethylformamid, N-Methylpyrrolidon, Acetonitril, Dichlormethan und Wasser[1], sowie in Methanol und Dimethylsulfoxid[6] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen und Darstellung
Ethyl-2-cyano-2-(hydroxyimino)acetat wird bei der Reaktion von Cyanessigsäureethylester und Salpetriger Säure (aus Natriumnitrit und Essigsäure) in 87%iger Ausbeute erhalten.[8]
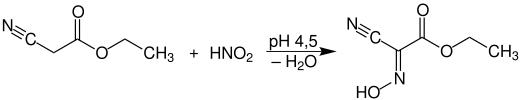
Wegen der Hydrolyseneigung des Esters sollte die Reaktion bei pH 4,5 durchgeführt werden, wobei das Produkt in gepufferter Phosphorsäure in praktisch quantitativer Ausbeute anfällt.[1]
Die Verbindung kann durch Umkristallisieren aus Ethanol[1] oder Ethylacetat[9] gereinigt werden.
Im Vergleich zu den als Peptidverknüpfungsreagentien weit verbreiteten und als explosionsgefährlich geltenden Benzotriazol-Derivaten 1-Hydroxybenzotriazol (HOBt) und 1-Hydroxy-7-azabenzotriazol (HOAt) zeigt Hydroxyiminocyanessigsäure-ethylester eine wesentlich verlangsamte thermische Zersetzung beim Erhitzen.[7]
Eigenschaften
Ethyl-2-cyano-2-(hydroxyimino)acetat ist ein weißer Feststoff, der in vielen, bei der Synthese von Peptiden üblichen, Lösungsmitteln, wie z. B. Dichlormethan (DCM) oder Dimethylformamid (DMF), löslich ist.
Als kristalline Substanz liegt die Verbindung als Oxim vor, während sie in anionischer Form als Salz oder in stark basischer Lösung überwiegend als tautomeres Nitrosoisomer existiert.[10]
Anwendungen
Aufgrund der einfachen präparativen Zugänglichkeit, des unkritischen Verhaltens bei Temperaturen unterhalb 80 °C und insbesondere wegen der hohen Ausbeuten und der geringen Racemisierung der erhaltenen Peptide hat Hydroxyiminocyanessigsäureethylester inzwischen eine weitere Verbreitung als Additiv bei Peptidsynthesen gefunden.[7][10][11]
Hydroxyiminocyanessigsäureethylester kann als Kupplungsadditiv bei der konventionellen Peptidverknüpfung in Lösung wie bei der automatisierten Merrifield-Synthese an einem festen Trägerharz (engl. solid-phase peptide synthesis (SPPS)) zusammen mit Kopplungsreagenzien wie Carbodiimiden, z. B. Dicyclohexylcarbodiimid (DCC), Diisopropylcarbodiimid (DIC)[12] oder auch dem wasserlöslichen 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimid-Hydrochlorid (EDCI), eingesetzt werden.[13]

So liefert die stufenweise Flüssigphasensynthese des Dipeptids Z-L-Phg-L-Val-OMe aus mit der Benzyloxycarbonyl-Gruppe (Z-Gruppe) N-geschütztem Z-L-α-Phenylglycin und L-Valinmethylester mit dem Kupplungsreagenz DIC und dem Additiv Hydroxyiminocyanessigsäureethylester eine Produktausbeute (LL-Dipeptid) von 81–84 %, das frei ist von racemischem DL-Dipeptid.[13]
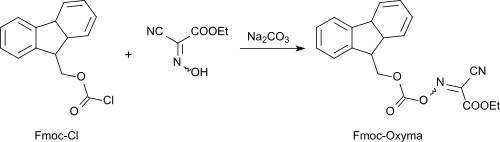
In jüngerer Zeit ist eine Vielzahl von Derivaten des Hydroxyiminocyanessigsäureethylesters (Oxyma) als Acylierungs-reagentien[14] entwickelt worden, wie z. B. Fmoc-Oxyma zur Übertragung der Fluorenylmethoxycarbonyl-Schutzgruppe[15]
oder dem als Dimethylmorpholin-uroniumsalz gut löslichen Kopplungsreagenz COMU, das wie Oxyma bezüglich Unterdrückung der Racemisierung und Acylierungseffizienz dem Standardadditiv HOBt überlegen und mit HOAt vergleichbar ist, ohne ein Explosionsrisiko wie die Benzotriazole darzustellen.[10]
Selbst für die Verknüpfung von geschützten Aminosäuren zu Oligopeptiden in Wasser ist mit wasserlöslichen Derivaten des Hydroxyiminocyanessigsäureethylesters (Glyceroacetonid-Oxyma) als Additiv und DIC als Kopplungsreagenz in schwach basischer wässriger Lösung mit den Modellsubstanzen Z-L-Phg-OH und L-H-Pro-NH2
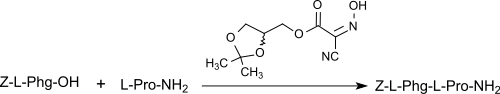
mit einer chemischen Ausbeute von 95 % und einem Diastereomerenüberschuss von > 99 % möglich.[16]
Bei der Kopplung von Aminosäuren häufig auftretende Nebenreaktionen, wie z. B. Bildung symmetrischer Säureanhydride, Racemisierung und Epimerisierung oder Cyclisierung zu Oxazolinonen oder – insbesondere von Dipeptiden – zu 2,5-Diketopiperazinen, werden durch das Kopplungsadditiv Ethyl-2-cyano-2-(hydroxyimino)acetat weitgehend unterdrückt.
Einzelnachweise
- F. Albericio, R. Subirós-Funosas: Ethyl 2-Cyano-2-(hydroxyimino)acetate. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2012, doi:10.1002/047084289X.rn01377.
- Datenblatt Hydroxyimino-cyanessigsäure-ethylester bei Sigma-Aldrich, abgerufen am 5. Oktober 2016 (PDF).
- Datenblatt Ethyl isonitrosocyanoacetate 97% bei AlfaAesar, abgerufen am 16. Juni 2017 (PDF) (JavaScript erforderlich).
- Eintrag zu Ethyl cyano(hydroxyimino)acetate bei TCI Europe, abgerufen am 5. Oktober 2016.
- M. Itoh: Peptides. IV. Racemization suppression by the use of ethyl 2-hydroxyimino-2-cyanoacetate and its amide. In: Bull. Chem. Soc. Jpn. Band 46, 1973, S. 2219–2221, doi:10.1246/bcsj.46.2219.
- Eintrag zu Ethyl Cyano(hydroxyimino)acetate bei Toronto Research Chemicals, abgerufen am 5. Oktober 2016 (PDF).
- R. Subirós-Funosas, R. Prohens, R. Barbas, A. El-Faham, F. Albericio: Oxyma: An efficient additive for peptide synthesis to replace the benzotriazole-based HOBt and HOAt with a lower risk of explosion. In: Chem. Eur. J. Band 15, Nr. 37, 2009, S. 9394–9403, doi:10.1002/chem.200900614.
- M. Conrad, A. Schulze: Über Nitroso-cyanessigsäure-Derivate. In: Chem. Ber. Band 42, Nr. 1, 1909, S. 735–742, doi:10.1002/cber.190904201117.
- Patent US5166394: Coupling reagent for peptide synthesis. Angemeldet am 21. Mai 1991, veröffentlicht am 2. November 1992, Anmelder: Hoechst AG, Erfinder: G. Breipohl, W. König.
- R. Subirós-Funosas, S.N. Khattab, L. Nieto-Rodriguez, A. El-Faham, F. Albericio: Advances in acylation methodologies enabled by Oxyma-based reagents. In: Aldrichimica Acta. Band 46, Nr. 1, 2013, S. 21–41 (ub.edu [PDF]).
- Coupling Reagents Bachem. (PDF; 1,9 MB) In: bachem.com. Global Marketing, Bachem Group, 2015, abgerufen am 10. Oktober 2016 (englisch).
- A. El-Faham, Z. Al Marhoon, A. Abdel-Megeed, F. Albericio: OxymaPure/DIC: An Efficient Reagent for the Synthesis of a Novel Series of 4-[2-(2-Acetylaminophenyl)-2-oxo-acetylamino] Benzoyl Amino Acid Ester Derivatives. In: Molecules. Band 18, 2013, S. 14747–14759, doi:10.3390/molecules181214747.
- R. Subirós-Funosas, A. El-Faham, F. Albericio: Low-epimerization Peptide Bond Formation with Oxyma Pure: Preparation of Z-L-Phg-Val-OMe In: Organic Syntheses. 90, 2013, S. 306–315, doi:10.15227/orgsyn.090.0306 (PDF).
- A. El-Faham, F. Albericio: Peptide coupling reagents, more than a letter soup. In: Chem. Rev. Band 111, Nr. 11, 2011, S. 6557–6602, doi:10.1021/cr.100048w.
- S.N. Khattab, R. Subirós-Funosas, A. El-Faham, F. Albericio: Oxime Carbonates: Novel Reagents for the Introduction of Fmoc and Alloc Protecting Groups, Free of Side Reactions. In: Eur. J. Org. Chem. Band 17, 2010, S. 3275–3280, doi:10.1002/ejoc.201000028.
- Q. Wang, Y. Wang, M. Kurosu: A new Oxyma derivative for nonracemizable amide-forming reactions in water. In: Org. Lett. Band 14, Nr. 13, 2012, S. 3375–3375, doi:10.1021/o3013556.
