Benzotriazol
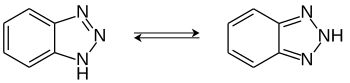
1H-Benzotriazol ist eine organische Chemikalie mit einer 1,2,3-Triazolstruktur, die als Komplexbildner Verwendung findet. Eine strukturisomere Verbindung, mit der 1H-Benzotriazol im tautomeren Gleichgewicht steht, ist das 2H-Benzotriazol.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
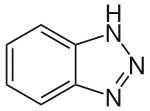 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Benzotriazol | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C6H5N3 | |||||||||||||||
| Kurzbeschreibung |
beigefarbener Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 119,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
350 °C[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| pKS-Wert | ||||||||||||||||
| Löslichkeit |
wenig in Wasser (19 g·l−1 bei 20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Eigenschaften
1H-Benzotriazol ist ein weißes, kristallines Pulver, welches nach Aufreinigung durch mehrmalige Sublimation im Hochvakuum bei 100,5 °C schmilzt.[5] Die Verbindung kristallisiert in einem monoklinen Kristallgitter.[6] Der bei einer Sublimation relevante Dampfdruck liegt im Temperaturbereich zwischen 53,4 °C und 71,7 °C zwischen 90 mPa und 640 mPa und kann mittels der Gleichung lg(p/Pa)=5159,5(T/K)−1+14,77 beschrieben werden.[7] Die Sublimationsenthalpie beträgt bei 25 °C ΔsubH = 98,15 kJ/mol, bei 63,4 °C ΔsubH = 96,30 kJ/mol.[8]
Die Verbindung zersetzt sich oberhalb des Schmelzpunktes stark exotherm.[9] Eine Destillation der Verbindung ist deshalb nicht ratsam. Eine Quelle[10] aus dem Jahr 1956 berichtet von einer explosiven Zersetzung eines Ansatzes von einer Tonne während der Destillation bei 160 °C und 2,5 hPa. Bei einer thermoanalytischen Untersuchung zeigte sich ab 240 °C eine Zersetzungsreaktion mit einer sehr hohen Reaktionswärme von −1590 kJ/kg.[9] Trotz der hohen Zersetzungswärme ist die Verbindung nicht explosionsgefährlich im Sinne des Sprengstoffgesetzes, da keiner der für die Einordnung relevanten Tests wie z. B. der BAM 50/60 Stahlrohrtest oder der Koenen-Test (bei 1 mm Bohrung der Düsenplatte: Typ O) ein positives Ergebnis liefert.[9]
Zwischen 1H-Benzotriazol und 2H-Benzotriazol kann ein Tautomeriegleichgewicht formuliert werden. Experimentelle Messungen und quantenchemische Berechnungen zeigen aber, dass in fester Phase sowie in Lösung dieses Gleichgewicht praktisch auf der Seite des 1H-Benzotriazols liegt.[11][12][13] Dieses ist das energetisch günstigere Tautomer. Im photochemisch angeregten Triplettzustand ist allerdings das 2H-Tautomer energetisch begünstigt bzw. stabiler.[12]
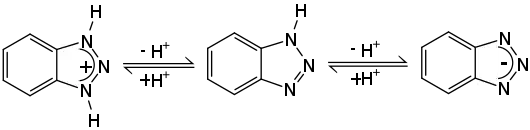
Benzotriazol besitzt amphiprotische Eigenschaften, kann also im sauren Medium protoniert bzw. im basischen Medium deprotoniert werden. Die Protolysekonstanten betragen pKa1 = 0,42 und pKa2 = 8,27.[4]
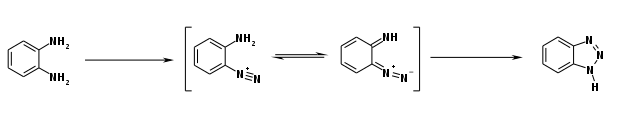
Gewinnung und Darstellung
Die Herstellung erfolgt durch ringschließende Diazotierung von o-Phenylendiamin mit Nitrit und (Essig-)Säure.[14]
Verwendung
Benzotriazol wird als Korrosionsschutzmittel, vor allem für Kupfer[15] in Kühlflüssigkeiten, Frostschutzmitteln, Enteisungsmitteln, sowie in Entkalkungstabletten eingesetzt. In Geschirrspülmitteln dient es als Silberschutz[15]. In der Industrie wird es in Kühlschmiermitteln der Metallbearbeitung eingesetzt. In fotografischen Entwicklern dient es zur Verminderung von Schleierbildung auf dem Film.
Benzotriazol-Derivate (z. B. 5-Methyl-1H-benzotriazol) kommen beispielsweise als Frostschutzmittel,[16] UV-Filter, in Solarzellen oder bei medizinischen Anwendungen zum Einsatz.[17]
Umweltrelevanz
Benzotriazol ist relativ gut wasserlöslich und schwer abbaubar. Es wird daher in Kläranlagen nur zu einem kleinen Anteil eliminiert und gelangt in großen Mengen in Flüsse und Seen.[18][19] In europäischen Flüssen werden typischerweise Konzentrationen im drei- bis vierstelligen Nanogramm-pro-Liter-Bereich gemessen.[20]
Sicherheitshinweise
Benzotriazol wurde 2014 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Benzotriazol waren die Besorgnisse bezüglich Umweltexposition sowie als potentieller endokriner Disruptor. Die Neubewertung läuft seit 2016 und wird von Deutschland durchgeführt. Um zu einer abschließenden Bewertung gelangen zu können, wurden weitere Informationen nachgefordert.[21]
Weblinks
Einzelnachweise
- Eintrag zu BENZOTRIAZOLE in der CosIng-Datenbank der EU-Kommission, abgerufen am 21. März 2020.
- Datenblatt Benzotriazol bei Sigma-Aldrich, abgerufen am 11. Juni 2011 (PDF).
- Eintrag zu Benzotriazol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- H. Wang, C. Burda, G. Persy, J. Wirz: Photochemistry of 1H-Benzotriazole in Aqueous Solution: A Photolatent Base. In: J. Am. Chem. Soc. 122 (2000), 5849–5855; doi:10.1021/ja994464c.
- K.W.F. Kohlrausch, R. Seka; Raman-Effekt und Konstitutions-Probleme, XIII. Mitteil.: Naphthalinartig kondensierte Hetero-bicyclen; Chemische Berichte 71 (1938), 1563–1570. doi:10.1002/cber.19380710803.
- A. Escande, J. L.Galigné, J. Lapasset: Structure cristalline et moléculaire du benzotriazole; Acta Cryst. B 30 (1974), 1490–1495; doi:10.1107/S0567740874005139.
- P. Jimenez, M. V. Roux, C. Turrion: Thermochemical properties of N-heterocyclic compounds II. Enthalpies of combustion, vapour pressures, enthalpies of sublimation, and enthalpies of formation of 1,2,4-triazole and benzotriazole; J. Chem. Thermodyn. 21 (1989), 759–764; doi:10.1016/0021-9614(89)90060-8
- R. Sabbah, L. Perez; Energetics of Intramolecular Bonds in 1H-1,2,4-Triazole and 1H-Benzotriazole, in: Austr. J. Chem. 1999, 52, 235–240; doi:10.1071/C99006.
- M. Malow, K. D. Wehrstedt, S. Neuenfeld: On the explosive properties of 1H-benzotriazole and 1H-1,2,3-triazole. Tetrahedron Letters 48 (2007), 1233–1235; doi:10.1016/j.tetlet.2006.12.046.
- Anon., Chem. Eng. News, 1956, 34, 2450
- F. Tomas; J.L.M. Abboud; J. Laynez; R. Notario; L. Santos; S.O. Nilsson; R.M. Claramunt; J Elguero: Tautomerism and aromaticity in 1,2,3-triazoles: The case of Benzotriazole in J. Am. Chem. Soc. 111 (1989) 7348–7353. doi:10.1021/ja00201a011.
- J. Catalan; P. Perez: Theoretical and experimental evidence on the structure of benzotriazole in its first triplet electronic state in Chem. Phys. Letters 404 (2005) 304–308. doi:10.1016/J.cplett.2005.01.107.
- A.R. Katritzky; K. Yannakopoulou; E. Anders; J. Stephens; M. Szafran: Ab initio and semiempirical calculations on the tautomeric equilibria of N-unsubstituted and N-substituted benzotriazoles. In: J. Org. Chem. 55 (1990 5683–5687). doi:10.1021/jo00309a009.
- Patent US4299965A: Preparation of benzotriazole. Angemeldet am 30. Juni 1980, veröffentlicht am 10. November 1981, Anmelder: Calgon Corp, Erfinder: Marie S. Chan, Wood E. Hunter.
- Eintrag zu 1H-Benzotriazol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Mai 2019.
- Datenblatt 5-Methyl-1H-benzotriazole bei Sigma-Aldrich, abgerufen am 2. Februar 2019 (PDF).
- K. Bajaj, R. Sakhuja: Benzotriazole: Much More Than Just Synthetic Heterocyclic Chemistry. In: J. C. Monbaliu (Hrsg.): The Chemistry of Benzotriazole Derivatives. Topics in Heterocyclic Chemistry, Auflage 43. Springer, Cham 2015, doi:10.1007/7081_2015_198, ISBN 978-3-319-31552-2, ISBN 978-3-319-31554-6.
- W. Giger, C. Schaffner, HP. Kohler (2006): Benzotriazole and Tolyltriazole as Aquatic Contaminants. 1. Input and Occurrence in Rivers and Lakes. Environ. Sci. Technol. 40, S. 7186–7192. PMID 17180965.
- Frostschutzmittel in der Nordsee entdeckt. In: welt.de. 30. November 2011, abgerufen am 1. Mai 2015.
- Robert Loos, Bernd Manfred Gawlik, Giovanni Locoro, Erika Rimaviciute, Serafino Contini, Giovanni Bidoglio: EU-wide survey of polar organic persistent pollutants in European river waters. In: Environmental Pollution. 2009. doi:10.1016/j.envpol.2008.09.020.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Benzotriazole, abgerufen am 26. März 2019.

